Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
研究新型单克隆抗体mAb059c与hPD-1受体的相互作用。
Scientific Reports ( IF 3.8 ) Pub Date : 2019-11-28 , DOI: 10.1038/s41598-019-54231-w Jingxian Liu 1 , Guiqun Wang 1 , Liu Liu 1 , Runjie Wu 1 , Yi Wu 1 , Cheng Fang 1 , Xinhong Zhou 1 , Jing Jiao 1 , Ying Gu 1 , He Zhou 1 , Zhenhui Xie 1 , Zhiwu Sun 1 , Dakai Chen 1 , Ken Dai 2 , Dongxu Wang 2 , Wei Tang 1 , Teddy Tat Chi Yang 1
Scientific Reports ( IF 3.8 ) Pub Date : 2019-11-28 , DOI: 10.1038/s41598-019-54231-w Jingxian Liu 1 , Guiqun Wang 1 , Liu Liu 1 , Runjie Wu 1 , Yi Wu 1 , Cheng Fang 1 , Xinhong Zhou 1 , Jing Jiao 1 , Ying Gu 1 , He Zhou 1 , Zhenhui Xie 1 , Zhiwu Sun 1 , Dakai Chen 1 , Ken Dai 2 , Dongxu Wang 2 , Wei Tang 1 , Teddy Tat Chi Yang 1
Affiliation
|
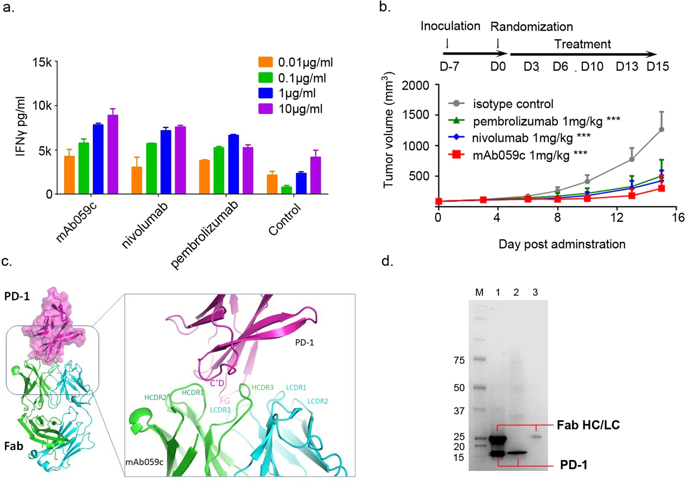
程序性细胞死亡1(PD-1)单克隆抗体已获得监管机构的批准,可用于治疗各种类型的癌症,其机制涉及T细胞功能的恢复。我们在本文中以1.70Å的分辨率报道了与PD-1细胞外域(ECD)结合的完全人源单克隆抗体mAb059c片段抗原结合(Fab)的X射线晶体结构。结构分析表明:1)包含PD-1 C'D,BC和FG环片段的表位有助于mAb059c相互作用,2)C'D环的独特构型和R86的不同方向可以捕获抗体互补决定区(CDR)形成PD-1,并形成一个盐桥接触-ASP101(HCDR3):ARG86(PD-1),3)通过第二个盐桥和两个主链氢键维持FG与轻链(LC)CDR3的接触。界面分析表明,PD-1上的N-糖基化位点49、74和116不接触mAb059c。而BC环中的N58被mAb059c重链CDR1和CDR2识别。N58的突变减弱了mAb059c与PD-1的结合。这些发现和新颖的抗PD-1抗体将有助于更好地理解抗PD-1 mAb对PD-1受体的分子识别机制,从而能够开发出具有更大疗效范围的新疗法满足未满足的医疗需求。而BC环中的N58被mAb059c重链CDR1和CDR2识别。N58的突变减弱了mAb059c与PD-1的结合。这些发现和新颖的抗PD-1抗体将有助于更好地理解抗PD-1 mAb对PD-1受体的分子识别机制,从而能够开发出具有更大疗效范围的新疗法满足未满足的医疗需求。而BC环中的N58被mAb059c重链CDR1和CDR2识别。N58的突变减弱了mAb059c与PD-1的结合。这些发现和新颖的抗PD-1抗体将有助于更好地理解抗PD-1 mAb对PD-1受体的分子识别机制,从而能够开发出具有更大疗效范围的新疗法满足未满足的医疗需求。

"点击查看英文标题和摘要"
更新日期:2019-11-29

"点击查看英文标题和摘要"






























 京公网安备 11010802027423号
京公网安备 11010802027423号