Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
The structures and gating mechanism of human calcium homeostasis modulator 2
Nature ( IF 50.5 ) Pub Date : 2019-11-27 , DOI: 10.1038/s41586-019-1781-3
Wooyoung Choi 1 , Nicolina Clemente 1 , Weinan Sun 2, 3 , Juan Du 1 , Wei Lü 1
Nature ( IF 50.5 ) Pub Date : 2019-11-27 , DOI: 10.1038/s41586-019-1781-3
Wooyoung Choi 1 , Nicolina Clemente 1 , Weinan Sun 2, 3 , Juan Du 1 , Wei Lü 1
Affiliation
|
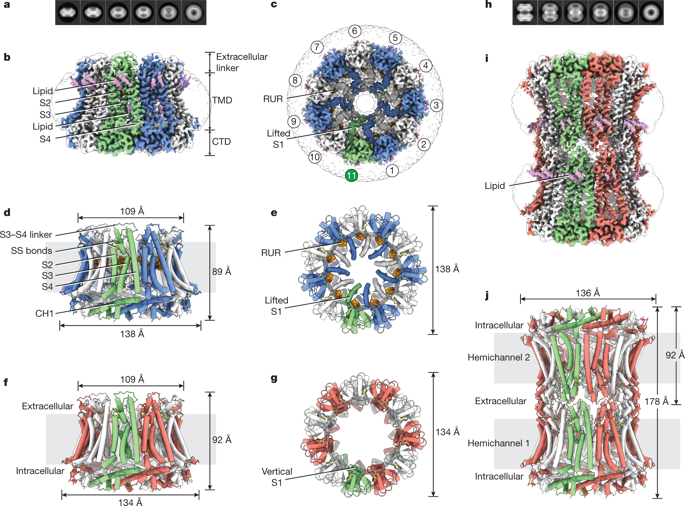
Calcium homeostasis modulators (CALHMs) are voltage-gated, Ca2+-inhibited nonselective ion channels that act as major ATP release channels, and have important roles in gustatory signalling and neuronal toxicity1–3. Dysfunction of CALHMs has previously been linked to neurological disorders1. Here we present cryo-electron microscopy structures of the human CALHM2 channel in the Ca2+-free active or open state and in the ruthenium red (RUR)-bound inhibited state, at resolutions up to 2.7 Å. Our work shows that purified CALHM2 channels form both gap junctions and undecameric hemichannels. The protomer shows a mirrored arrangement of the transmembrane domains (helices S1–S4) relative to other channels with a similar topology, such as connexins, innexins and volume-regulated anion channels4–8. Upon binding to RUR, we observed a contracted pore with notable conformational changes of the pore-lining helix S1, which swings nearly 60° towards the pore axis from a vertical to a lifted position. We propose a two-section gating mechanism in which the S1 helix coarsely adjusts, and the N-terminal helix fine-tunes, the pore size. We identified a RUR-binding site near helix S1 that may stabilize this helix in the lifted conformation, giving rise to channel inhibition. Our work elaborates on the principles of CALHM2 channel architecture and symmetry, and the mechanism that underlies channel inhibition.Cryo-electron microscopy structures of the active and inhibited human CALHM2 channel suggest a two-stage gating mechanism in which the S1 helix adjusts the pore size, which is then fine-tuned by the N-terminal helix.
中文翻译:

人钙稳态调节剂2的结构和门控机制
钙稳态调节剂 (CALHM) 是电压门控、Ca2+ 抑制的非选择性离子通道,充当主要的 ATP 释放通道,在味觉信号传导和神经元毒性中具有重要作用 1-3。CALHMs 的功能障碍以前与神经系统疾病有关。在这里,我们展示了人类 CALHM2 通道在无 Ca2+ 活性或开放状态和钌红 (RUR) 结合抑制状态下的冷冻电子显微镜结构,分辨率高达 2.7 Å。我们的工作表明纯化的 CALHM2 通道形成间隙连接和 undecameric 半通道。原体显示跨膜结构域(螺旋 S1-S4)相对于其他具有相似拓扑结构的通道的镜像排列,例如连接蛋白、连接蛋白和体积调节的阴离子通道 4-8。绑定到 RUR 后,我们观察到一个收缩的孔隙,具有显着的孔隙衬里螺旋 S1 的构象变化,它从垂直位置到提升位置向孔隙轴摆动近 60°。我们提出了一种两段式门控机制,其中 S1 螺旋粗调,N 端螺旋微调孔径。我们在螺旋 S1 附近发现了一个 RUR 结合位点,它可以稳定这个螺旋在提升的构象中,引起通道抑制。我们的工作详细阐述了 CALHM2 通道结构和对称性的原理,以及通道抑制的机制。活跃和受抑制的人类 CALHM2 通道的冷冻电子显微镜结构表明了一个两阶段的门控机制,其中 S1 螺旋调节孔径,然后通过 N 端螺旋对其进行微调。从垂直位置到提升位置向孔隙轴摆动近 60°。我们提出了一种两段式门控机制,其中 S1 螺旋粗调,N 端螺旋微调孔径。我们在螺旋 S1 附近发现了一个 RUR 结合位点,它可以稳定这个螺旋在提升的构象中,引起通道抑制。我们的工作详细阐述了 CALHM2 通道结构和对称性的原理,以及通道抑制的机制。活跃和受抑制的人类 CALHM2 通道的冷冻电子显微镜结构表明了一个两阶段的门控机制,其中 S1 螺旋调节孔径,然后通过 N 端螺旋对其进行微调。从垂直位置到提升位置向孔隙轴摆动近 60°。我们提出了一种两段式门控机制,其中 S1 螺旋粗调,N 端螺旋微调孔径。我们在螺旋 S1 附近发现了一个 RUR 结合位点,它可以稳定这个螺旋在提升的构象中,引起通道抑制。我们的工作详细阐述了 CALHM2 通道结构和对称性的原理,以及通道抑制的机制。活跃和受抑制的人类 CALHM2 通道的冷冻电子显微镜结构表明了一个两阶段的门控机制,其中 S1 螺旋调节孔径,然后通过 N 端螺旋对其进行微调。我们提出了一种两段式门控机制,其中 S1 螺旋粗调,N 端螺旋微调孔径。我们在螺旋 S1 附近发现了一个 RUR 结合位点,它可以稳定这个螺旋在提升的构象中,引起通道抑制。我们的工作详细阐述了 CALHM2 通道结构和对称性的原理,以及通道抑制的机制。活跃和受抑制的人类 CALHM2 通道的冷冻电子显微镜结构表明了一个两阶段的门控机制,其中 S1 螺旋调节孔径,然后通过 N 端螺旋对其进行微调。我们提出了一种两段式门控机制,其中 S1 螺旋粗调,N 端螺旋微调孔径。我们在螺旋 S1 附近发现了一个 RUR 结合位点,它可以稳定这个螺旋在提升的构象中,引起通道抑制。我们的工作详细阐述了 CALHM2 通道结构和对称性的原理,以及通道抑制的机制。活跃和受抑制的人类 CALHM2 通道的冷冻电子显微镜结构表明了一个两阶段的门控机制,其中 S1 螺旋调节孔径,然后通过 N 端螺旋对其进行微调。
更新日期:2019-11-27
中文翻译:

人钙稳态调节剂2的结构和门控机制
钙稳态调节剂 (CALHM) 是电压门控、Ca2+ 抑制的非选择性离子通道,充当主要的 ATP 释放通道,在味觉信号传导和神经元毒性中具有重要作用 1-3。CALHMs 的功能障碍以前与神经系统疾病有关。在这里,我们展示了人类 CALHM2 通道在无 Ca2+ 活性或开放状态和钌红 (RUR) 结合抑制状态下的冷冻电子显微镜结构,分辨率高达 2.7 Å。我们的工作表明纯化的 CALHM2 通道形成间隙连接和 undecameric 半通道。原体显示跨膜结构域(螺旋 S1-S4)相对于其他具有相似拓扑结构的通道的镜像排列,例如连接蛋白、连接蛋白和体积调节的阴离子通道 4-8。绑定到 RUR 后,我们观察到一个收缩的孔隙,具有显着的孔隙衬里螺旋 S1 的构象变化,它从垂直位置到提升位置向孔隙轴摆动近 60°。我们提出了一种两段式门控机制,其中 S1 螺旋粗调,N 端螺旋微调孔径。我们在螺旋 S1 附近发现了一个 RUR 结合位点,它可以稳定这个螺旋在提升的构象中,引起通道抑制。我们的工作详细阐述了 CALHM2 通道结构和对称性的原理,以及通道抑制的机制。活跃和受抑制的人类 CALHM2 通道的冷冻电子显微镜结构表明了一个两阶段的门控机制,其中 S1 螺旋调节孔径,然后通过 N 端螺旋对其进行微调。从垂直位置到提升位置向孔隙轴摆动近 60°。我们提出了一种两段式门控机制,其中 S1 螺旋粗调,N 端螺旋微调孔径。我们在螺旋 S1 附近发现了一个 RUR 结合位点,它可以稳定这个螺旋在提升的构象中,引起通道抑制。我们的工作详细阐述了 CALHM2 通道结构和对称性的原理,以及通道抑制的机制。活跃和受抑制的人类 CALHM2 通道的冷冻电子显微镜结构表明了一个两阶段的门控机制,其中 S1 螺旋调节孔径,然后通过 N 端螺旋对其进行微调。从垂直位置到提升位置向孔隙轴摆动近 60°。我们提出了一种两段式门控机制,其中 S1 螺旋粗调,N 端螺旋微调孔径。我们在螺旋 S1 附近发现了一个 RUR 结合位点,它可以稳定这个螺旋在提升的构象中,引起通道抑制。我们的工作详细阐述了 CALHM2 通道结构和对称性的原理,以及通道抑制的机制。活跃和受抑制的人类 CALHM2 通道的冷冻电子显微镜结构表明了一个两阶段的门控机制,其中 S1 螺旋调节孔径,然后通过 N 端螺旋对其进行微调。我们提出了一种两段式门控机制,其中 S1 螺旋粗调,N 端螺旋微调孔径。我们在螺旋 S1 附近发现了一个 RUR 结合位点,它可以稳定这个螺旋在提升的构象中,引起通道抑制。我们的工作详细阐述了 CALHM2 通道结构和对称性的原理,以及通道抑制的机制。活跃和受抑制的人类 CALHM2 通道的冷冻电子显微镜结构表明了一个两阶段的门控机制,其中 S1 螺旋调节孔径,然后通过 N 端螺旋对其进行微调。我们提出了一种两段式门控机制,其中 S1 螺旋粗调,N 端螺旋微调孔径。我们在螺旋 S1 附近发现了一个 RUR 结合位点,它可以稳定这个螺旋在提升的构象中,引起通道抑制。我们的工作详细阐述了 CALHM2 通道结构和对称性的原理,以及通道抑制的机制。活跃和受抑制的人类 CALHM2 通道的冷冻电子显微镜结构表明了一个两阶段的门控机制,其中 S1 螺旋调节孔径,然后通过 N 端螺旋对其进行微调。

































 京公网安备 11010802027423号
京公网安备 11010802027423号