当前位置:
X-MOL 学术
›
J. Proteome Res.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
无标记交互作用分析揭示了CUL3-KEAP1复合体在介导PHD2泛素化和降解中的重要作用。
Journal of Proteome Research ( IF 3.8 ) Pub Date : 2019-12-06 , DOI: 10.1021/acs.jproteome.9b00513 Ang Luo 1 , Yue Chen 1
Journal of Proteome Research ( IF 3.8 ) Pub Date : 2019-12-06 , DOI: 10.1021/acs.jproteome.9b00513 Ang Luo 1 , Yue Chen 1
Affiliation
|
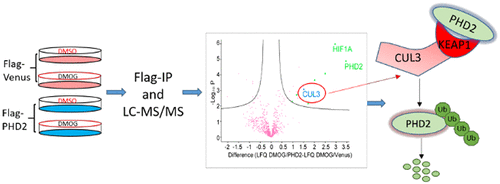
含有脯氨酰羟化酶结构域的蛋白质2(PHD2 / EGLN1)是一种关键的调节酶,在细胞低氧反应途径中起着基本作用,介导脯氨酸羟化依赖性蛋白质对选定目标蛋白质的降解。然而,对PHD2动态平衡在蛋白质水平上的调节尚不十分了解。在这里,我们通过免疫沉淀与质谱分析进行无标记的定量相互作用组分析。为了最大程度地减少由异位过表达引起的副作用,我们在HeLa细胞中稳定表达了带有Flag标签的PHD2,同时通过使用靶向其3'UTR区的shRNA抑制了内源性PHD2。我们鉴定并验证了Cullin 3作为体内新型PHD2相互作用子。通过候选人筛选,我们进一步确定了CUL3-KEAP1 E3泛素连接酶复合物是调节PHD2降解的主要酶。CUL3,KEAP1或两者的过度表达会显着增加PHD2泛素化并降低PHD2蛋白的丰度。敲低CUL3或KEAP1降低PHD2泛素化并抑制PHD2降解。因此,缺氧下CUL3-KEAP1复合物的缺失促进了PHD2的稳定,并导致PHD2靶标(低氧诱导因子1A(HIF1A))的丰度大大降低。因此,CUL3-KEAP1是调节细胞中PHD2泛素化和降解的重要途径。敲低CUL3或KEAP1降低PHD2泛素化并抑制PHD2降解。因此,缺氧下CUL3-KEAP1复合物的缺失促进了PHD2的稳定,并导致PHD2靶标(低氧诱导因子1A(HIF1A))的丰度大大降低。因此,CUL3-KEAP1是调节细胞中PHD2泛素化和降解的重要途径。敲低CUL3或KEAP1降低PHD2泛素化并抑制PHD2降解。因此,缺氧下CUL3-KEAP1复合物的缺失促进了PHD2的稳定,并导致PHD2靶标(低氧诱导因子1A(HIF1A))的丰度大大降低。因此,CUL3-KEAP1是调节细胞中PHD2泛素化和降解的重要途径。

"点击查看英文标题和摘要"
更新日期:2019-12-06

"点击查看英文标题和摘要"





















































 京公网安备 11010802027423号
京公网安备 11010802027423号