Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Improved Cas9 activity by specific modifications of the tracrRNA.
Scientific Reports ( IF 3.8 ) Pub Date : 2019-11-06 , DOI: 10.1038/s41598-019-52616-5 Tristan Scott 1 , Ryan Urak 1 , Citradewi Soemardy 1 , Kevin V Morris 1
Scientific Reports ( IF 3.8 ) Pub Date : 2019-11-06 , DOI: 10.1038/s41598-019-52616-5 Tristan Scott 1 , Ryan Urak 1 , Citradewi Soemardy 1 , Kevin V Morris 1
Affiliation
|
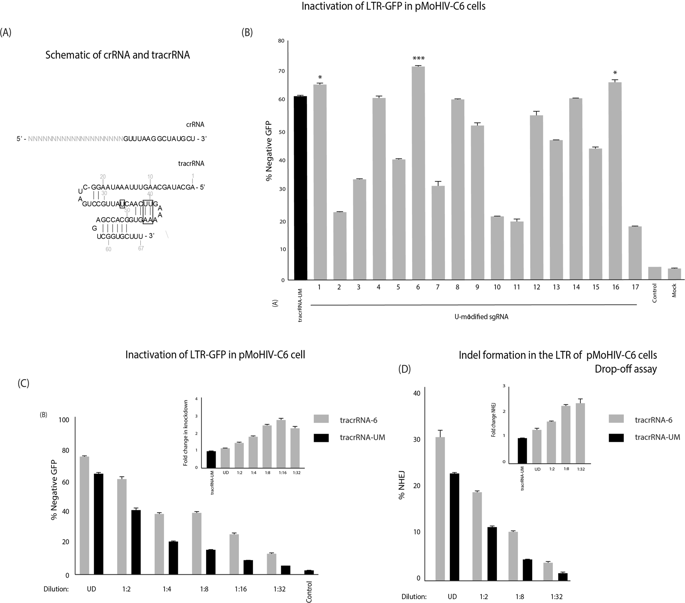
CRISPR/Cas is a transformative gene editing tool, that offers a simple and effective way to target a catalytic Cas9, the most widely used is derived from Streptococcus pyogenes (SpCas9), with a complementary small guide RNA (sgRNA) to inactivate endogenous genes resulting from insertions and deletions (indels). CRISPR/Cas9 has been rapidly applied to basic research as well as expanded for potential clinical applications. Utilization of spCas9 as an ribonuclearprotein complex (RNP) is considered the most safe and effective method to apply Cas9 technology, and the efficacy of this system is critically dependent on the ability of Cas9 to generate high levels of indels. We find here that novel sequence changes to the tracrRNA significantly improves Cas9 activity when delivered as an RNP. We demonstrate that a dual-guide RNA (dgRNA) with a modified tracrRNA can improve reporter knockdown and indel formation at several targets within the long terminal repeat (LTR) of HIV. Furthermore, the sequence-modified tracrRNAs improved Cas9-mediated reduction of CCR5 surface receptor expression in cell lines, which correlated with higher levels of indel formation. It was demonstrated that a Cas9 RNP with a sequence modified tracrRNA enhanced indel formation at the CCR5 target site in primary CD4+ T-cells. Finally, we show improved activity at two additional targets within the HBB locus and the BCL11A GATA site. Overall, the data presented here suggests that novel facile tracrRNA sequence changes could potentially be integrated with current dgRNA technology, and open up the possibility for the development of sequence modified tracrRNAs to improve Cas9 RNP activity.
中文翻译:

通过对 tracrRNA 进行特定修饰来提高 Cas9 活性。
CRISPR/Cas是一种革命性的基因编辑工具,它提供了一种简单有效的方法来靶向催化Cas9,最广泛使用的是衍生自化脓性链球菌(SpCas9)的,具有互补的小向导RNA(sgRNA)来灭活内源基因所产生的来自插入和删除(indels)。 CRISPR/Cas9 已迅速应用于基础研究,并扩展到潜在的临床应用。利用spCas9作为核糖核蛋白复合物(RNP)被认为是应用Cas9技术最安全、最有效的方法,该系统的功效很大程度上取决于Cas9产生高水平插入缺失的能力。我们在这里发现,当以 RNP 形式递送时,tracrRNA 的新序列变化显着提高了 Cas9 活性。我们证明,具有修饰的 tracrRNA 的双引导 RNA (dgRNA) 可以改善 HIV 长末端重复 (LTR) 内多个靶标的报告基因敲低和插入缺失形成。此外,序列修饰的 tracrRNA 改善了 Cas9 介导的细胞系中 CCR5 表面受体表达的减少,这与更高水平的 indel 形成相关。结果表明,具有序列修饰的 tracrRNA 的 Cas9 RNP 增强了原代 CD4+ T 细胞中 CCR5 靶位点的 indel 形成。最后,我们发现 HBB 基因座和 BCL11A GATA 位点内的两个额外靶标的活性有所改善。总体而言,这里提供的数据表明,新颖的简便 tracrRNA 序列改变有可能与当前的 dgRNA 技术整合,并为开发序列修饰的 tracrRNA 以提高 Cas9 RNP 活性提供了可能性。
更新日期:2019-11-06
中文翻译:

通过对 tracrRNA 进行特定修饰来提高 Cas9 活性。
CRISPR/Cas是一种革命性的基因编辑工具,它提供了一种简单有效的方法来靶向催化Cas9,最广泛使用的是衍生自化脓性链球菌(SpCas9)的,具有互补的小向导RNA(sgRNA)来灭活内源基因所产生的来自插入和删除(indels)。 CRISPR/Cas9 已迅速应用于基础研究,并扩展到潜在的临床应用。利用spCas9作为核糖核蛋白复合物(RNP)被认为是应用Cas9技术最安全、最有效的方法,该系统的功效很大程度上取决于Cas9产生高水平插入缺失的能力。我们在这里发现,当以 RNP 形式递送时,tracrRNA 的新序列变化显着提高了 Cas9 活性。我们证明,具有修饰的 tracrRNA 的双引导 RNA (dgRNA) 可以改善 HIV 长末端重复 (LTR) 内多个靶标的报告基因敲低和插入缺失形成。此外,序列修饰的 tracrRNA 改善了 Cas9 介导的细胞系中 CCR5 表面受体表达的减少,这与更高水平的 indel 形成相关。结果表明,具有序列修饰的 tracrRNA 的 Cas9 RNP 增强了原代 CD4+ T 细胞中 CCR5 靶位点的 indel 形成。最后,我们发现 HBB 基因座和 BCL11A GATA 位点内的两个额外靶标的活性有所改善。总体而言,这里提供的数据表明,新颖的简便 tracrRNA 序列改变有可能与当前的 dgRNA 技术整合,并为开发序列修饰的 tracrRNA 以提高 Cas9 RNP 活性提供了可能性。





















































 京公网安备 11010802027423号
京公网安备 11010802027423号