Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
着丝粒蛋白shugoshin 2与HSF1在热休克反应和RNA Pol II募集中协同作用。
The EMBO Journal ( IF 9.4 ) Pub Date : 2019-10-28 , DOI: 10.15252/embj.2019102566
Ryosuke Takii 1 , Mitsuaki Fujimoto 1 , Masaki Matsumoto 2 , Pratibha Srivastava 1 , Arpit Katiyar 1 , Keiich I Nakayama 2, 3 , Akira Nakai 1
The EMBO Journal ( IF 9.4 ) Pub Date : 2019-10-28 , DOI: 10.15252/embj.2019102566
Ryosuke Takii 1 , Mitsuaki Fujimoto 1 , Masaki Matsumoto 2 , Pratibha Srivastava 1 , Arpit Katiyar 1 , Keiich I Nakayama 2, 3 , Akira Nakai 1
Affiliation
|
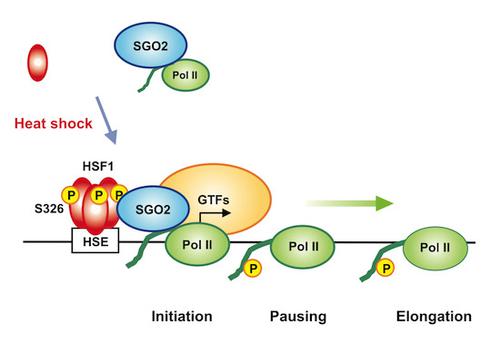
在基因快速诱导过程中,RNA聚合酶II(Pol II)向核心启动子的募集受到高度调节。响应热休克,热休克转录因子1(HSF1)被激活并占据热休克基因启动子。与启动子结合的HSF1募集与Pol II相互作用的通用转录因子和介体,但尚不清楚Pol II募集的应激特异性机制。在这里,我们在对HSF1旁系同源物及其突变体的比较分析中显示,在小鼠细胞热休克期间,HSF1与腹膜中心衔接蛋白shugoshin 2(SGO2)相互作用,其方式取决于在丝氨酸326上HSF1的诱导磷酸化,并募集SGO2 HSP70启动子。SGO2介导的具有磷酸化C末端结构域的Pol II的结合和募集会促进HSP70的表达,暗示SGO2是促进HSF1招募Pol II的共激活因子之一。此外,HSF1-SGO2复合物在热休克条件下支持细胞存活和蛋白变性的维持。这些结果例证了Pol II募集的蛋白毒性应激特异性机制,该机制是由热休克反应中HSF1的磷酸化触发的。

"点击查看英文标题和摘要"
更新日期:2019-12-17

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号