当前位置:
X-MOL 学术
›
DNA Repair
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Ligand binding characteristics of the Ku80 von Willebrand domain.
DNA Repair ( IF 3.0 ) Pub Date : 2019-10-24 , DOI: 10.1016/j.dnarep.2019.102739
Kyungmin Kim 1 , Jungki Min 1 , Thomas W Kirby 1 , Scott A Gabel 1 , Lars C Pedersen 1 , Robert E London 1
DNA Repair ( IF 3.0 ) Pub Date : 2019-10-24 , DOI: 10.1016/j.dnarep.2019.102739
Kyungmin Kim 1 , Jungki Min 1 , Thomas W Kirby 1 , Scott A Gabel 1 , Lars C Pedersen 1 , Robert E London 1
Affiliation
|
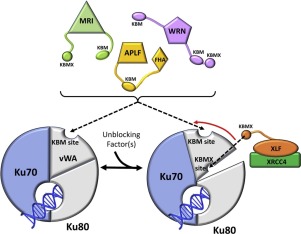
The N-terminal von Willebrand domain of Ku80 supports interactions with a Ku binding motif (KBM) that has been identified in at least three other DNA repair proteins: the non-homologous end joining (NHEJ) scaffold APLF, the modulator of retrovirus infection, MRI, and the Werner syndrome protein (WRN). A second, more recently identified Ku binding motif present in XLF and several other proteins (KBMX) has also been reported to interact with this domain. The isolated Ku80 von Willebrand antigen domain (vWA) from Xenopus laevis has a sequence that is 60% identical with the human domain, is readily expressed and has been used to investigate these interactions. Structural characterization of the complexes formed with the KBM motifs in human APLF, MRI, and WRN identify a conserved binding site that is consistent with previously-reported mutational studies. In contrast with the KBM binding site, structural studies indicate that the KBMX site is occluded by a distorted helix. Fluorescence polarization and 19F NMR studies of a fluorinated XLF C-terminal peptide failed to indicate any interaction with the frog vWA. It was hypothesized that availability of this binding site is conditional, i.e., dependent on specific experimental conditions or other repair factors to make the site available for binding. Modulating the fraction of KBMX-accessible binding site mutationally demonstrated that the more open site is capable of binding the KBMXXLF motif peptide. It is suggested that the conditional nature of KBMX binding limits formation of non-productive complexes so that activation-dependent site availability can more optimally support advancing the synapsis process.
中文翻译:

Ku80 von Willebrand 结构域的配体结合特征。
Ku80 的 N 端冯维勒布兰德结构域支持与 Ku 结合基序 (KBM) 的相互作用,该基序已在至少三种其他 DNA 修复蛋白中被鉴定:非同源末端连接 (NHEJ) 支架 APLF,逆转录病毒感染的调节剂, MRI 和维尔纳综合征蛋白 (WRN)。据报道,XLF 和其他几种蛋白质 (KBMX) 中存在的第二个最近发现的 Ku 结合基序也与该结构域相互作用。从非洲爪蟾中分离出的 Ku80 冯维勒布兰德抗原结构域 (vWA) 具有与人类结构域 60% 相同的序列,易于表达,并已用于研究这些相互作用。在人类 APLF、MRI 和 WRN 中用 KBM 基序形成的复合物的结构表征确定了一个保守的结合位点,该位点与之前报道的突变研究一致。与 KBM 结合位点相反,结构研究表明 KBMX 位点被扭曲的螺旋封闭。氟化 XLF C 端肽的荧光偏振和 19F NMR 研究未能表明与青蛙 vWA 有任何相互作用。假设该结合位点的可用性是有条件的,即取决于特定的实验条件或其他修复因素以使该位点可用于结合。通过突变调节 KBMX 可接近的结合位点的部分表明,更开放的位点能够结合 KBMXXLF 基序肽。这表明 KBMX 结合的条件性质限制了非生产性复合物的形成,使得激活依赖性位点可用性可以更优化地支持突触过程的推进。
更新日期:2019-10-25
中文翻译:

Ku80 von Willebrand 结构域的配体结合特征。
Ku80 的 N 端冯维勒布兰德结构域支持与 Ku 结合基序 (KBM) 的相互作用,该基序已在至少三种其他 DNA 修复蛋白中被鉴定:非同源末端连接 (NHEJ) 支架 APLF,逆转录病毒感染的调节剂, MRI 和维尔纳综合征蛋白 (WRN)。据报道,XLF 和其他几种蛋白质 (KBMX) 中存在的第二个最近发现的 Ku 结合基序也与该结构域相互作用。从非洲爪蟾中分离出的 Ku80 冯维勒布兰德抗原结构域 (vWA) 具有与人类结构域 60% 相同的序列,易于表达,并已用于研究这些相互作用。在人类 APLF、MRI 和 WRN 中用 KBM 基序形成的复合物的结构表征确定了一个保守的结合位点,该位点与之前报道的突变研究一致。与 KBM 结合位点相反,结构研究表明 KBMX 位点被扭曲的螺旋封闭。氟化 XLF C 端肽的荧光偏振和 19F NMR 研究未能表明与青蛙 vWA 有任何相互作用。假设该结合位点的可用性是有条件的,即取决于特定的实验条件或其他修复因素以使该位点可用于结合。通过突变调节 KBMX 可接近的结合位点的部分表明,更开放的位点能够结合 KBMXXLF 基序肽。这表明 KBMX 结合的条件性质限制了非生产性复合物的形成,使得激活依赖性位点可用性可以更优化地支持突触过程的推进。

































 京公网安备 11010802027423号
京公网安备 11010802027423号