当前位置:
X-MOL 学术
›
Cell Death Dis.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
嘌呤合成中靶向MTHFD2和PAICS的组合靶向是一种新型治疗策略。
Cell Death & Disease ( IF 8.1 ) Pub Date : 2019-10-17 , DOI: 10.1038/s41419-019-2033-z Chantal Hoi Yin Cheung,Chia-Lang Hsu,Chao-Yin Tsuei,Tzu-Ting Kuo,Chen-Tsung Huang,Wen-Ming Hsu,Yun-Hsien Chung,Hsin-Yi Wu,Cheng-Chih Hsu,Hsuan-Cheng Huang,Hsueh-Fen Juan
Cell Death & Disease ( IF 8.1 ) Pub Date : 2019-10-17 , DOI: 10.1038/s41419-019-2033-z Chantal Hoi Yin Cheung,Chia-Lang Hsu,Chao-Yin Tsuei,Tzu-Ting Kuo,Chen-Tsung Huang,Wen-Ming Hsu,Yun-Hsien Chung,Hsin-Yi Wu,Cheng-Chih Hsu,Hsuan-Cheng Huang,Hsueh-Fen Juan
|
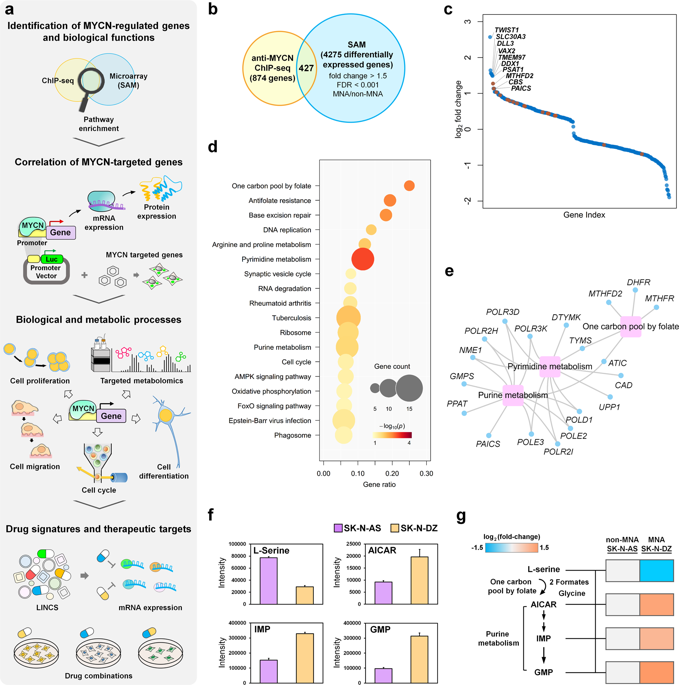
MYCN扩增(MNA)神经母细胞瘤是一种侵略性神经c衍生的儿童癌症。然而,MYCN对于发育是必不可少的,并且在转录上调节广泛的基因网络。整合抗MYCN ChIP-seq和神经母细胞瘤患者的基因表达谱后发现,一碳代谢和嘌呤生物合成所需的代谢酶MTHFD2和PAICS同时被上调,对转移性神经母细胞瘤更敏感。此外,我们发现MYCN通过MTHFD2介导了叶酸循环,它贡献了一个碳单元来增强嘌呤合成,并进一步调节了PAICS响应于癌症的发展而产生的核苷酸。在MNA神经母细胞瘤细胞中,MYCN靶向基因对MTHFD2和PAICS的双重敲低协同作用降低了细胞增殖,集落形成,迁移能力和DNA合成。通过系统地筛选化合物微扰,通过细胞株中的茴香霉素和芹菜素特异性抑制了MTHFD2和PAICS的基因表达水平,我们的共同治疗结果也显示出对MNA神经母细胞瘤细胞增殖的协同抑制作用。共同地,靶向MYCN靶向基因的组合来中断代谢途径的相互连接,可以克服药物毒性并改善当前治疗剂在MNA神经母细胞瘤中的功效。

"点击查看英文标题和摘要"
更新日期:2019-10-17

"点击查看英文标题和摘要"






























 京公网安备 11010802027423号
京公网安备 11010802027423号