当前位置:
X-MOL 学术
›
Mater. Des.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Bioactivity of catalase loaded into vaterite CaCO3 crystals via adsorption and co-synthesis
Materials & Design ( IF 7.6 ) Pub Date : 2020-01-01 , DOI: 10.1016/j.matdes.2019.108223
Natalia A. Feoktistova , Anna S. Vikulina , Nadezhda G. Balabushevich , Andre G. Skirtach , Dmitry Volodkin
Materials & Design ( IF 7.6 ) Pub Date : 2020-01-01 , DOI: 10.1016/j.matdes.2019.108223
Natalia A. Feoktistova , Anna S. Vikulina , Nadezhda G. Balabushevich , Andre G. Skirtach , Dmitry Volodkin
|
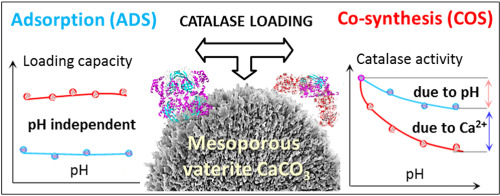
Abstract Protein therapy gained a reputation of the most direct and safe approach for treating various diseases, yet biodegradation and loss of bioactivity of fragile therapeutic proteins limit their wide medical use. Recently, a new hard templating technology using decomposable mesoporous vaterite CaCO3 crystals became extremely popular strategy for formulation of protein nano(micro)-vectors. This study deciphers how protein bioactivity depends on protein loading/release for this technology utilizing catalase as a promising antioxidant therapeutic agent. Catalase has been loaded into CaCO3 using two approaches: i) passive - via adsorption (ADS) into pre-formed crystals and ii) active - via co-synthesis (COS) in the pH range 8–10. Crystal morphology, protein secondary structure and enzymatic bioactivity, and protein retention upon washing are assessed. The activity reduction (∼70% for COS and ∼20% for ADS) is caused by both protein exposure to an alkaline medium and protein aggregation induced by Ca2+. The aggregation significantly governs protein release kinetics. Catalase loading into the crystals is pH-independent and van der Waals interactions dominate over the electrostatics, while catalase activity strongly depends on pH. This study implicates the prime role of loading/release mechanism in the preservation of protein bioactivity and guide for the control over the retention of protein bioactivity.
中文翻译:

通过吸附和共合成加载到球霰石 CaCO3 晶体中的过氧化氢酶的生物活性
摘要 蛋白质疗法被誉为治疗各种疾病最直接、最安全的方法,但脆弱的治疗性蛋白质的生物降解和生物活性丧失限制了其广泛的医疗用途。最近,一种使用可分解介孔球霰石 CaCO3 晶体的新硬模板技术成为蛋白质纳米(微)载体配方中非常流行的策略。这项研究解释了蛋白质生物活性如何依赖于该技术的蛋白质加载/释放,该技术利用过氧化氢酶作为一种有前途的抗氧化治疗剂。已使用两种方法将过氧化氢酶加载到 CaCO3 中:i) 被动 - 通过吸附 (ADS) 到预先形成的晶体中和 ii) 主动 - 通过共合成 (COS) 在 pH 值范围 8-10 中。晶体形态、蛋白质二级结构和酶促生物活性,和评估洗涤后的蛋白质保留。活性降低(COS 约 70%,ADS 约 20%)是由蛋白质暴露于碱性介质和 Ca2+ 诱导的蛋白质聚集引起的。聚集显着控制蛋白质释放动力学。加载到晶体中的过氧化氢酶与 pH 值无关,范德华相互作用支配静电,而过氧化氢酶活性强烈依赖于 pH 值。该研究暗示了加载/释放机制在蛋白质生物活性保存中的主要作用,并指导控制蛋白质生物活性的保留。加载到晶体中的过氧化氢酶与 pH 值无关,范德华相互作用支配静电,而过氧化氢酶活性强烈依赖于 pH 值。该研究暗示了加载/释放机制在蛋白质生物活性保存中的主要作用,并指导控制蛋白质生物活性的保留。加载到晶体中的过氧化氢酶与 pH 值无关,范德华相互作用支配静电,而过氧化氢酶活性强烈依赖于 pH 值。该研究暗示了加载/释放机制在蛋白质生物活性保存中的主要作用,并指导控制蛋白质生物活性的保留。
更新日期:2020-01-01
中文翻译:

通过吸附和共合成加载到球霰石 CaCO3 晶体中的过氧化氢酶的生物活性
摘要 蛋白质疗法被誉为治疗各种疾病最直接、最安全的方法,但脆弱的治疗性蛋白质的生物降解和生物活性丧失限制了其广泛的医疗用途。最近,一种使用可分解介孔球霰石 CaCO3 晶体的新硬模板技术成为蛋白质纳米(微)载体配方中非常流行的策略。这项研究解释了蛋白质生物活性如何依赖于该技术的蛋白质加载/释放,该技术利用过氧化氢酶作为一种有前途的抗氧化治疗剂。已使用两种方法将过氧化氢酶加载到 CaCO3 中:i) 被动 - 通过吸附 (ADS) 到预先形成的晶体中和 ii) 主动 - 通过共合成 (COS) 在 pH 值范围 8-10 中。晶体形态、蛋白质二级结构和酶促生物活性,和评估洗涤后的蛋白质保留。活性降低(COS 约 70%,ADS 约 20%)是由蛋白质暴露于碱性介质和 Ca2+ 诱导的蛋白质聚集引起的。聚集显着控制蛋白质释放动力学。加载到晶体中的过氧化氢酶与 pH 值无关,范德华相互作用支配静电,而过氧化氢酶活性强烈依赖于 pH 值。该研究暗示了加载/释放机制在蛋白质生物活性保存中的主要作用,并指导控制蛋白质生物活性的保留。加载到晶体中的过氧化氢酶与 pH 值无关,范德华相互作用支配静电,而过氧化氢酶活性强烈依赖于 pH 值。该研究暗示了加载/释放机制在蛋白质生物活性保存中的主要作用,并指导控制蛋白质生物活性的保留。加载到晶体中的过氧化氢酶与 pH 值无关,范德华相互作用支配静电,而过氧化氢酶活性强烈依赖于 pH 值。该研究暗示了加载/释放机制在蛋白质生物活性保存中的主要作用,并指导控制蛋白质生物活性的保留。

































 京公网安备 11010802027423号
京公网安备 11010802027423号