当前位置:
X-MOL 学术
›
Food Hydrocoll.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
不同内质鸡蛋卵粘蛋白的流变学和结构特性
Food Hydrocolloids ( IF 11.0 ) Pub Date : 2020-03-01 , DOI: 10.1016/j.foodhyd.2019.105393 Yuanyuan Shan , Dengyu Tang , Rong Wang , Aobai Tu , Yanglei Yi , Xin Wang , Bianfang Liu , Yuan Zhou , Qun Huang , Xin Lü
Food Hydrocolloids ( IF 11.0 ) Pub Date : 2020-03-01 , DOI: 10.1016/j.foodhyd.2019.105393 Yuanyuan Shan , Dengyu Tang , Rong Wang , Aobai Tu , Yanglei Yi , Xin Wang , Bianfang Liu , Yuan Zhou , Qun Huang , Xin Lü
|
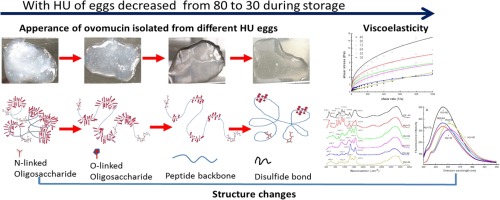
摘要 假设卵粘蛋白是蛋清凝胶状性质的原因。然而,很少有研究揭示来自不同内部质量的鸡蛋的卵粘蛋白的流变学特性和构象变化。在这项研究中,卵粘蛋白是从具有不同哈夫单位 (HU) 值的鸡蛋中分离出来的,由于储存的原因,其范围为 80 到 30。使用流变学、DLS、荧光、CD和FTIR光谱分析卵粘蛋白的粘弹性和结构特征。流变学数据显示,随着 HU 值的降低,卵粘蛋白凝胶的粘度和弹性模量 (G') 显着降低。在卵粘蛋白含量中观察到相同的趋势。粒径分布结果表明,低HU鸡蛋的卵粘蛋白平均粒径更小,分布范围更广。当 HU 从 80 降低到 64 时,800-1200 cm-1 处红外吸收峰的蓝移和消失证实了卵粘蛋白中糖苷键的解离。红外和CD光谱结果表明,当HU从80降低到64时,卵粘蛋白从分子间β-折叠和α-螺旋结构转变为无规卷曲结构,并且拉伸的蛋白质重新形成有序的二级结构,如β-转角当 HU 从 53 进一步下降到 30 时,鸡蛋的卵粘蛋白二级结构中存在中间形式,HU 介于 64 和 53 之间,表明卵粘蛋白的构象转变不符合简单的双态机制。Zeta 电位和疏水性测量进一步证实了中间态的存在。800-1200 cm-1 处红外吸收峰的蓝移和消失证实了卵粘蛋白中糖苷键的解离。红外和CD光谱结果表明,当HU从80降低到64时,卵粘蛋白从分子间β-折叠和α-螺旋结构转变为无规卷曲结构,并且拉伸的蛋白质重新形成有序的二级结构,如β-转角当 HU 从 53 进一步下降到 30 时,鸡蛋的卵粘蛋白二级结构中有一个中间形式,HU 介于 64 和 53 之间,表明卵粘蛋白的构象转变不符合简单的双态机制。Zeta 电位和疏水性测量进一步证实了中间态的存在。800-1200 cm-1 处红外吸收峰的蓝移和消失证实了卵粘蛋白中糖苷键的解离。红外和CD光谱结果表明,当HU从80降低到64时,卵粘蛋白从分子间β-折叠和α-螺旋结构转变为无规卷曲结构,并且拉伸的蛋白质重新形成有序的二级结构,如β-转角当 HU 从 53 进一步下降到 30 时,鸡蛋的卵粘蛋白二级结构中有一个中间形式,HU 介于 64 和 53 之间,表明卵粘蛋白的构象转变不符合简单的双态机制。Zeta 电位和疏水性测量进一步证实了中间态的存在。

"点击查看英文标题和摘要"
更新日期:2020-03-01

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号