当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Synaptotagmin 1 clamps synaptic vesicle fusion in mammalian neurons independent of complexin.
Nature Communications ( IF 14.7 ) Pub Date : 2019-09-09 , DOI: 10.1038/s41467-019-12015-w Nicholas A Courtney 1 , Huan Bao 1 , Joseph S Briguglio 1 , Edwin R Chapman 1
Nature Communications ( IF 14.7 ) Pub Date : 2019-09-09 , DOI: 10.1038/s41467-019-12015-w Nicholas A Courtney 1 , Huan Bao 1 , Joseph S Briguglio 1 , Edwin R Chapman 1
Affiliation
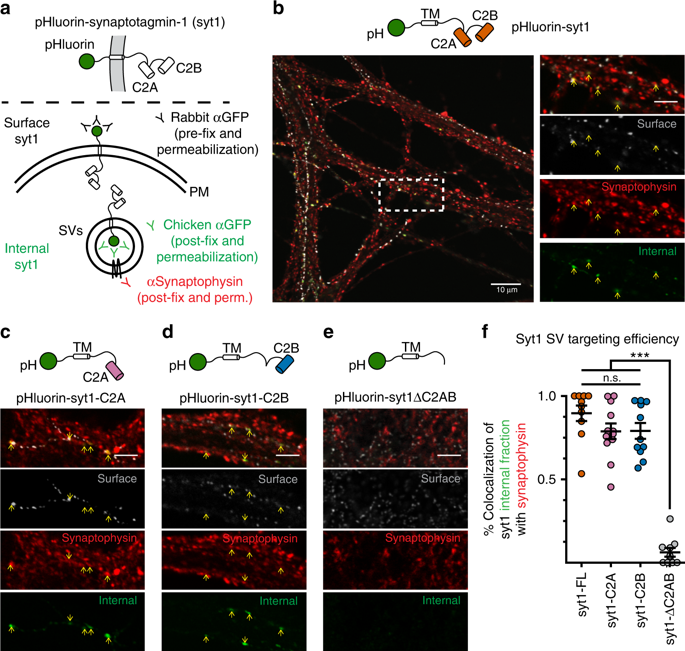
|
Synaptic vesicle (SV) exocytosis is mediated by SNARE proteins. Reconstituted SNAREs are constitutively active, so a major focus has been to identify fusion clamps that regulate their activity in synapses: the primary candidates are synaptotagmin (syt) 1 and complexin I/II. Syt1 is a Ca2+ sensor for SV release that binds Ca2+ via tandem C2-domains, C2A and C2B. Here, we first determined whether these C2-domains execute distinct functions. Remarkably, the C2B domain profoundly clamped all forms of SV fusion, despite synchronizing residual evoked release and rescuing the readily-releasable pool. Release was strongly enhanced by an adjacent C2A domain, and by the concurrent binding of complexin to trans-SNARE complexes. Knockdown of complexin had no impact on C2B-mediated clamping of fusion. We postulate that the C2B domain of syt1, independent of complexin, is the molecular clamp that arrests SVs prior to Ca2+-triggered fusion.
中文翻译:

突触结合蛋白 1 不依赖于复合蛋白而钳制哺乳动物神经元中的突触小泡融合。
突触小泡 (SV) 胞吐作用由 SNARE 蛋白介导。重组的 SNARE 具有组成型活性,因此主要焦点是识别调节其在突触中活性的融合夹:主要候选者是突触结合蛋白 (syt) 1 和复合蛋白 I/II。Syt1 是一种用于 SV 释放的 Ca2+ 传感器,通过串联 C2 结构域、C2A 和 C2B 结合 Ca2+。在这里,我们首先确定这些 C2 域是否执行不同的功能。值得注意的是,尽管同步了残余诱发释放并拯救了易于释放的池,但 C2B 结构域深刻地钳制了所有形式的 SV 融合。相邻的 C2A 结构域以及复合物与反式 SNARE 复合物的同时结合强烈增强了释放。复合蛋白的敲低对 C2B 介导的融合钳制没有影响。我们假设 syt1 的 C2B 结构域独立于复合蛋白,是在 Ca2+ 触发融合之前阻止 SV 的分子夹。
更新日期:2019-09-09
中文翻译:

突触结合蛋白 1 不依赖于复合蛋白而钳制哺乳动物神经元中的突触小泡融合。
突触小泡 (SV) 胞吐作用由 SNARE 蛋白介导。重组的 SNARE 具有组成型活性,因此主要焦点是识别调节其在突触中活性的融合夹:主要候选者是突触结合蛋白 (syt) 1 和复合蛋白 I/II。Syt1 是一种用于 SV 释放的 Ca2+ 传感器,通过串联 C2 结构域、C2A 和 C2B 结合 Ca2+。在这里,我们首先确定这些 C2 域是否执行不同的功能。值得注意的是,尽管同步了残余诱发释放并拯救了易于释放的池,但 C2B 结构域深刻地钳制了所有形式的 SV 融合。相邻的 C2A 结构域以及复合物与反式 SNARE 复合物的同时结合强烈增强了释放。复合蛋白的敲低对 C2B 介导的融合钳制没有影响。我们假设 syt1 的 C2B 结构域独立于复合蛋白,是在 Ca2+ 触发融合之前阻止 SV 的分子夹。






























 京公网安备 11010802027423号
京公网安备 11010802027423号