Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
IDH2 deficiency increases bone mass with reduced osteoclastogenesis by limiting RANKL expression in osteoblasts
Bone ( IF 3.5 ) Pub Date : 2019-12-01 , DOI: 10.1016/j.bone.2019.115056 Suk Hee Lee 1 , Seung-Hoon Lee 1 , Jin Hyup Lee 2 , Jeen-Woo Park 3 , Jung-Eun Kim 1
Bone ( IF 3.5 ) Pub Date : 2019-12-01 , DOI: 10.1016/j.bone.2019.115056 Suk Hee Lee 1 , Seung-Hoon Lee 1 , Jin Hyup Lee 2 , Jeen-Woo Park 3 , Jung-Eun Kim 1
Affiliation
|
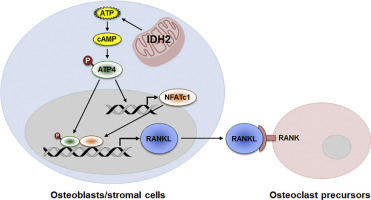
Mitochondria are not only responsible for cellular energy production but are also involved in signaling, cellular differentiation, cell death, and aging. Mitochondrial NADP+-dependent isocitrate dehydrogenase (IDH2) catalyzes the decarboxylation of isocitrate to α-ketoglutarate, accompanied by NADPH production. IDH2 plays a central role in mitochondrial function in multiple cell types and various organs, including the heart, kidneys, and brain. However, the function of IDH2 in bone tissue is yet to be elucidated. Here, we report that disruption of IDH2 in mice results in high bone mass due to decreased osteoclast number and resorption activity. Although IDH2 played no cell-intrinsic role in osteoclasts, IDH2-deficient animals showed decreased serum markers of osteoclast activity and bone resorption. Bone marrow stromal cells/osteoblasts from Idh2 knockout mice were defective in promoting osteoclastogenesis due to a reduced expression of a key osteoclastogenic factor, receptor activator of nuclear factor-κB ligand (RANKL), in osteoblasts in vivo and in vitro through the attenuation of ATF4-NFATc1 signaling. Our findings suggest that IDH2 is a novel regulator of osteoblast-to-osteoclast communication and bone metabolism, acting via the ATF4-NFATc1-RANKL signaling axis in osteoblasts, and they provide a rationale for further study of IDH2 as a potential therapeutic target for the prevention of bone loss.
中文翻译:

IDH2缺乏通过限制成骨细胞中的RANKL表达来增加骨量并减少破骨细胞生成
线粒体不仅负责细胞能量的产生,还参与信号传导、细胞分化、细胞死亡和衰老。线粒体 NADP+ 依赖性异柠檬酸脱氢酶 (IDH2) 催化异柠檬酸脱羧为 α-酮戊二酸,同时产生 NADPH。IDH2 在多种细胞类型和各种器官(包括心脏、肾脏和大脑)的线粒体功能中发挥着核心作用。然而,IDH2在骨组织中的功能尚未阐明。在这里,我们报告说,由于破骨细胞数量和再吸收活性降低,小鼠体内 IDH2 的破坏会导致高骨量。尽管 IDH2 在破骨细胞中没有发挥细胞内在的作用,但 IDH2 缺陷的动物显示破骨细胞活性和骨吸收的血清标志物降低。来自 Idh2 基因敲除小鼠的骨髓基质细胞/成骨细胞在促进破骨细胞生成方面存在缺陷,原因是关键的破骨细胞生成因子、核因子-κB 配体的受体激活剂 (RANKL) 在体内和体外的成骨细胞中通过 ATF4 的衰减表达降低-NFATc1 信号。我们的研究结果表明,IDH2 是成骨细胞与破骨细胞通讯和骨代谢的新型调节剂,通过成骨细胞中的 ATF4-NFATc1-RANKL 信号轴起作用,它们为进一步研究 IDH2 作为潜在治疗靶点提供了理论依据。预防骨质流失。通过衰减 ATF4-NFATc1 信号在体内和体外在成骨细胞中的作用。我们的研究结果表明,IDH2 是成骨细胞与破骨细胞通讯和骨代谢的新型调节剂,通过成骨细胞中的 ATF4-NFATc1-RANKL 信号轴起作用,它们为进一步研究 IDH2 作为潜在治疗靶点提供了理论依据。预防骨质流失。通过衰减 ATF4-NFATc1 信号在体内和体外在成骨细胞中的作用。我们的研究结果表明,IDH2 是成骨细胞与破骨细胞通讯和骨代谢的新型调节剂,通过成骨细胞中的 ATF4-NFATc1-RANKL 信号轴起作用,它们为进一步研究 IDH2 作为潜在治疗靶点提供了理论依据。预防骨质流失。
更新日期:2019-12-01
中文翻译:

IDH2缺乏通过限制成骨细胞中的RANKL表达来增加骨量并减少破骨细胞生成
线粒体不仅负责细胞能量的产生,还参与信号传导、细胞分化、细胞死亡和衰老。线粒体 NADP+ 依赖性异柠檬酸脱氢酶 (IDH2) 催化异柠檬酸脱羧为 α-酮戊二酸,同时产生 NADPH。IDH2 在多种细胞类型和各种器官(包括心脏、肾脏和大脑)的线粒体功能中发挥着核心作用。然而,IDH2在骨组织中的功能尚未阐明。在这里,我们报告说,由于破骨细胞数量和再吸收活性降低,小鼠体内 IDH2 的破坏会导致高骨量。尽管 IDH2 在破骨细胞中没有发挥细胞内在的作用,但 IDH2 缺陷的动物显示破骨细胞活性和骨吸收的血清标志物降低。来自 Idh2 基因敲除小鼠的骨髓基质细胞/成骨细胞在促进破骨细胞生成方面存在缺陷,原因是关键的破骨细胞生成因子、核因子-κB 配体的受体激活剂 (RANKL) 在体内和体外的成骨细胞中通过 ATF4 的衰减表达降低-NFATc1 信号。我们的研究结果表明,IDH2 是成骨细胞与破骨细胞通讯和骨代谢的新型调节剂,通过成骨细胞中的 ATF4-NFATc1-RANKL 信号轴起作用,它们为进一步研究 IDH2 作为潜在治疗靶点提供了理论依据。预防骨质流失。通过衰减 ATF4-NFATc1 信号在体内和体外在成骨细胞中的作用。我们的研究结果表明,IDH2 是成骨细胞与破骨细胞通讯和骨代谢的新型调节剂,通过成骨细胞中的 ATF4-NFATc1-RANKL 信号轴起作用,它们为进一步研究 IDH2 作为潜在治疗靶点提供了理论依据。预防骨质流失。通过衰减 ATF4-NFATc1 信号在体内和体外在成骨细胞中的作用。我们的研究结果表明,IDH2 是成骨细胞与破骨细胞通讯和骨代谢的新型调节剂,通过成骨细胞中的 ATF4-NFATc1-RANKL 信号轴起作用,它们为进一步研究 IDH2 作为潜在治疗靶点提供了理论依据。预防骨质流失。

































 京公网安备 11010802027423号
京公网安备 11010802027423号