当前位置:
X-MOL 学术
›
Exp. Mol. Med.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Identification of HDAC9 as a viable therapeutic target for the treatment of gastric cancer.
Experimental & Molecular Medicine ( IF 9.5 ) Pub Date : 2019-08-26 , DOI: 10.1038/s12276-019-0301-8 Kai Xiong 1, 2, 3 , Hejun Zhang 1, 3 , Yang Du 2, 4 , Jie Tian 2, 4, 5, 6 , Shigang Ding 1, 3
Experimental & Molecular Medicine ( IF 9.5 ) Pub Date : 2019-08-26 , DOI: 10.1038/s12276-019-0301-8 Kai Xiong 1, 2, 3 , Hejun Zhang 1, 3 , Yang Du 2, 4 , Jie Tian 2, 4, 5, 6 , Shigang Ding 1, 3
Affiliation
|
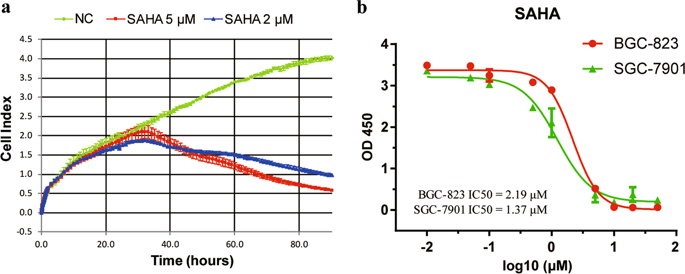
Histone deacetylase inhibitors (HDACis) are a new class of anticancer drugs confirmed to have good therapeutic effects against gastric cancer (GC) in preclinical experiments, but most HDACis are non-selective (pan-HDACis), with highly toxic side effects. Therefore, it is necessary to screen HDAC family members that play key roles in GC as therapeutic targets to reduce toxic side effects. In this study, we evaluated the targeting specificity of the HDACi suberoylanilide hydroxamic acid (SAHA) for GC via fluorescence molecular imaging (FMI). In vitro FMI results showed that SAHA had higher binding affinity for GC cells than for normal gastric cells. In vivo FMI of gastric tumor-bearing mice confirmed that SAHA can be enriched in GC tissues. However, there was also a high-concentration distribution in normal organs such as the stomach and lungs, suggesting potential side effects. In addition, we found that among the HDAC family members, HDAC9 was the most significantly upregulated in GC cells, and we verified this upregulation in GC tissues. Further experiments confirmed that knockdown of HDAC9 inhibits cell growth, reduces colony formation, and induces apoptosis and cell cycle arrest. These results suggest that HDAC9 has an oncogenic role in GC. Moreover, HDAC9 siRNA suppressed GC tumor growth and enhanced the antitumor efficacy of cisplatin in GC treatment by inhibiting the proliferation and inducing the apoptosis of GC cells in vitro and in vivo. Our findings suggest that the development of HDAC9-selective HDACis is a potential approach to improve the efficacy of chemotherapy and reduce systemic toxicity.
中文翻译:

将 HDAC9 鉴定为治疗胃癌的可行治疗靶点。
组蛋白去乙酰化酶抑制剂(HDACis)是一类新型抗癌药物,在临床前实验中证实对胃癌(GC)有良好的治疗效果,但大多数HDACis是非选择性的(pan-HDACis),毒副作用很大。因此,有必要筛选在GC中起关键作用的HDAC家族成员作为治疗靶点,以减少毒副作用。在这项研究中,我们通过荧光分子成像 (FMI) 评估了 HDACi 辛二酰苯胺异羟肟酸 (SAHA) 对 GC 的靶向特异性。体外 FMI 结果显示 SAHA 对 GC 细胞的结合亲和力高于对正常胃细胞的结合亲和力。胃肿瘤小鼠的体内 FMI 证实 SAHA 可以在 GC 组织中富集。但在胃、肺等正常器官中也有高浓度分布,暗示潜在的副作用。此外,我们发现在 HDAC 家族成员中,HDAC9 在 GC 细胞中上调最显着,我们在 GC 组织中验证了这种上调。进一步的实验证实,HDAC9 的敲低抑制细胞生长,减少集落形成,并诱导细胞凋亡和细胞周期停滞。这些结果表明 HDAC9 在 GC 中具有致癌作用。此外,HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡来抑制 GC 肿瘤的生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。我们发现在 HDAC 家族成员中,HDAC9 在 GC 细胞中上调最显着,我们在 GC 组织中验证了这种上调。进一步的实验证实,HDAC9 的敲低抑制细胞生长,减少集落形成,并诱导细胞凋亡和细胞周期停滞。这些结果表明 HDAC9 在 GC 中具有致癌作用。此外,HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡来抑制 GC 肿瘤的生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。我们发现在 HDAC 家族成员中,HDAC9 在 GC 细胞中上调最显着,我们在 GC 组织中验证了这种上调。进一步的实验证实,HDAC9 的敲低抑制细胞生长,减少集落形成,并诱导细胞凋亡和细胞周期停滞。这些结果表明 HDAC9 在 GC 中具有致癌作用。此外,HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡来抑制 GC 肿瘤的生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。进一步的实验证实,HDAC9 的敲低抑制细胞生长,减少集落形成,并诱导细胞凋亡和细胞周期停滞。这些结果表明 HDAC9 在 GC 中具有致癌作用。此外,HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡来抑制 GC 肿瘤的生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。进一步的实验证实,HDAC9 的敲低抑制细胞生长,减少集落形成,并诱导细胞凋亡和细胞周期停滞。这些结果表明 HDAC9 在 GC 中具有致癌作用。此外,HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡来抑制 GC 肿瘤的生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡,抑制 GC 肿瘤生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡,抑制 GC 肿瘤生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。
更新日期:2019-08-26
中文翻译:

将 HDAC9 鉴定为治疗胃癌的可行治疗靶点。
组蛋白去乙酰化酶抑制剂(HDACis)是一类新型抗癌药物,在临床前实验中证实对胃癌(GC)有良好的治疗效果,但大多数HDACis是非选择性的(pan-HDACis),毒副作用很大。因此,有必要筛选在GC中起关键作用的HDAC家族成员作为治疗靶点,以减少毒副作用。在这项研究中,我们通过荧光分子成像 (FMI) 评估了 HDACi 辛二酰苯胺异羟肟酸 (SAHA) 对 GC 的靶向特异性。体外 FMI 结果显示 SAHA 对 GC 细胞的结合亲和力高于对正常胃细胞的结合亲和力。胃肿瘤小鼠的体内 FMI 证实 SAHA 可以在 GC 组织中富集。但在胃、肺等正常器官中也有高浓度分布,暗示潜在的副作用。此外,我们发现在 HDAC 家族成员中,HDAC9 在 GC 细胞中上调最显着,我们在 GC 组织中验证了这种上调。进一步的实验证实,HDAC9 的敲低抑制细胞生长,减少集落形成,并诱导细胞凋亡和细胞周期停滞。这些结果表明 HDAC9 在 GC 中具有致癌作用。此外,HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡来抑制 GC 肿瘤的生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。我们发现在 HDAC 家族成员中,HDAC9 在 GC 细胞中上调最显着,我们在 GC 组织中验证了这种上调。进一步的实验证实,HDAC9 的敲低抑制细胞生长,减少集落形成,并诱导细胞凋亡和细胞周期停滞。这些结果表明 HDAC9 在 GC 中具有致癌作用。此外,HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡来抑制 GC 肿瘤的生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。我们发现在 HDAC 家族成员中,HDAC9 在 GC 细胞中上调最显着,我们在 GC 组织中验证了这种上调。进一步的实验证实,HDAC9 的敲低抑制细胞生长,减少集落形成,并诱导细胞凋亡和细胞周期停滞。这些结果表明 HDAC9 在 GC 中具有致癌作用。此外,HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡来抑制 GC 肿瘤的生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。进一步的实验证实,HDAC9 的敲低抑制细胞生长,减少集落形成,并诱导细胞凋亡和细胞周期停滞。这些结果表明 HDAC9 在 GC 中具有致癌作用。此外,HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡来抑制 GC 肿瘤的生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。进一步的实验证实,HDAC9 的敲低抑制细胞生长,减少集落形成,并诱导细胞凋亡和细胞周期停滞。这些结果表明 HDAC9 在 GC 中具有致癌作用。此外,HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡来抑制 GC 肿瘤的生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡,抑制 GC 肿瘤生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。HDAC9 siRNA 通过在体外和体内抑制 GC 细胞的增殖和诱导细胞凋亡,抑制 GC 肿瘤生长并增强顺铂在 GC 治疗中的抗肿瘤功效。我们的研究结果表明,开发 HDAC9 选择性 HDACis 是提高化疗疗效和降低全身毒性的潜在方法。













































 京公网安备 11010802027423号
京公网安备 11010802027423号