Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Increased glucocorticoid receptor activity and proliferation in metastatic colon cancer.
Scientific Reports ( IF 3.8 ) Pub Date : 2019-08-02 , DOI: 10.1038/s41598-019-47696-2 Dan Tian 1 , Miao Tian 2 , Gang Han 3 , Jin-Long Li 3
Scientific Reports ( IF 3.8 ) Pub Date : 2019-08-02 , DOI: 10.1038/s41598-019-47696-2 Dan Tian 1 , Miao Tian 2 , Gang Han 3 , Jin-Long Li 3
Affiliation
|
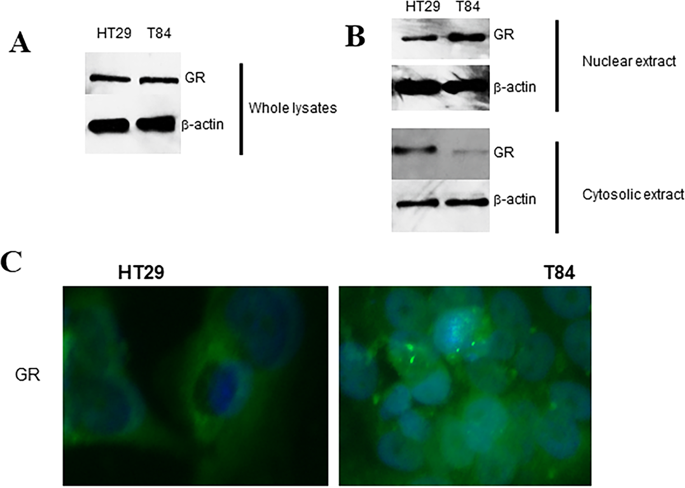
Metastasis is regarded as the fatal hallmark for colon cancer, but molecular mechanisms responsible for it have remained poorly defined. Glucocorticoid receptor (GR) within the tumor microenvironment mediates the effects of stress hormones which are used in clinics for their inflammation-modulatory and immunosuppressive properties. Further, epigenetic activation of GR promotes tumor heterogeneity and metastasis. Here, we sought to investigate the correlation between GR activation and proliferation and invasion in metastatic colon cancer microenvironment. We used proliferation/invasion assays, western blot, RT-qPCR, immunofluorescence staining and quantitative methylation to study glucocorticoid-GR signaling, including the involvement of CDK1, in human colon adenocarcinoma cell lines HT29 and T84 (a representative metastatic cell line). Nuclear expression levels of GR were significantly upregulated in metastatic T84 cells, and glucocorticoid derivative, dexamethasone (DEX) treatment caused increased proliferation and invasion in T84 cell, compared to HT29 cell. DEX treatment induced CDK1 expression which was accompanied by reduced CDK1 methylation, indicating epigenetic regulation. Depletion of GR suppressed proliferation of metastatic colon carcinoma cells and depletion of CDK1 had similar suppressing effects on proliferation as well as invasion of metastatic cells. Our study suggests that glucocorticoid-GR-CDK1 signaling induces proliferation and invasion of colon cancer cells and therapies involving the use of glucocorticoids need to exercise caution and re-evaluation.
中文翻译:

转移性结肠癌中糖皮质激素受体活性和增殖的增加。
转移被认为是结肠癌的致命标志,但是导致转移的分子机制仍然不清楚。肿瘤微环境中的糖皮质激素受体(GR)介导应激激素的作用,这种激素在临床上因其炎症调节和免疫抑制特性而被使用。此外,GR的表观遗传激活促进了肿瘤的异质性和转移。在这里,我们试图调查转移性结肠癌微环境中GR激活与增殖和侵袭之间的相关性。我们使用增殖/侵袭测定,蛋白质印迹,RT-qPCR,免疫荧光染色和定量甲基化研究了糖皮质激素-GR信号传导,包括CDK1在人结肠腺癌细胞系HT29和T84(一种代表性的转移性细胞系)中的参与。与HT29细胞相比,转移性T84细胞中GR的核表达水平显着上调,并且糖皮质激素衍生物地塞米松(DEX)处理导致T84细胞增殖和侵袭增加。DEX处理诱导CDK1表达,伴随CDK1甲基化降低,表明表观遗传调控。GR的消耗抑制了转移性结肠癌细胞的增殖,而CDK1的消耗对转移性癌细胞的增殖和侵袭具有相似的抑制作用。我们的研究表明,糖皮质激素-GR-CDK1信号会诱导结肠癌细胞的增殖和侵袭,涉及使用糖皮质激素的疗法需要谨慎和重新评估。与HT29细胞相比,地塞米松(DEX)处理导致T84细胞的增殖和侵袭增加。DEX处理诱导CDK1表达,伴随CDK1甲基化降低,表明表观遗传调控。GR的消耗抑制了转移性结肠癌细胞的增殖,而CDK1的消耗对转移性癌细胞的增殖和侵袭具有相似的抑制作用。我们的研究表明,糖皮质激素-GR-CDK1信号会诱导结肠癌细胞的增殖和侵袭,涉及使用糖皮质激素的疗法需要谨慎和重新评估。与HT29细胞相比,地塞米松(DEX)处理导致T84细胞的增殖和侵袭增加。DEX处理诱导CDK1表达,伴随CDK1甲基化降低,表明表观遗传调控。GR的消耗抑制了转移性结肠癌细胞的增殖,而CDK1的消耗对转移性癌细胞的增殖和侵袭具有相似的抑制作用。我们的研究表明,糖皮质激素-GR-CDK1信号会诱导结肠癌细胞的增殖和侵袭,涉及使用糖皮质激素的疗法需要谨慎和重新评估。GR的消耗抑制了转移性结肠癌细胞的增殖,而CDK1的消耗对转移性癌细胞的增殖和侵袭具有相似的抑制作用。我们的研究表明,糖皮质激素-GR-CDK1信号会诱导结肠癌细胞的增殖和侵袭,涉及使用糖皮质激素的疗法需要谨慎和重新评估。GR的消耗抑制了转移性结肠癌细胞的增殖,而CDK1的消耗对转移性癌细胞的增殖和侵袭具有相似的抑制作用。我们的研究表明,糖皮质激素-GR-CDK1信号会诱导结肠癌细胞的增殖和侵袭,涉及使用糖皮质激素的疗法需要谨慎和重新评估。
更新日期:2019-08-02
中文翻译:

转移性结肠癌中糖皮质激素受体活性和增殖的增加。
转移被认为是结肠癌的致命标志,但是导致转移的分子机制仍然不清楚。肿瘤微环境中的糖皮质激素受体(GR)介导应激激素的作用,这种激素在临床上因其炎症调节和免疫抑制特性而被使用。此外,GR的表观遗传激活促进了肿瘤的异质性和转移。在这里,我们试图调查转移性结肠癌微环境中GR激活与增殖和侵袭之间的相关性。我们使用增殖/侵袭测定,蛋白质印迹,RT-qPCR,免疫荧光染色和定量甲基化研究了糖皮质激素-GR信号传导,包括CDK1在人结肠腺癌细胞系HT29和T84(一种代表性的转移性细胞系)中的参与。与HT29细胞相比,转移性T84细胞中GR的核表达水平显着上调,并且糖皮质激素衍生物地塞米松(DEX)处理导致T84细胞增殖和侵袭增加。DEX处理诱导CDK1表达,伴随CDK1甲基化降低,表明表观遗传调控。GR的消耗抑制了转移性结肠癌细胞的增殖,而CDK1的消耗对转移性癌细胞的增殖和侵袭具有相似的抑制作用。我们的研究表明,糖皮质激素-GR-CDK1信号会诱导结肠癌细胞的增殖和侵袭,涉及使用糖皮质激素的疗法需要谨慎和重新评估。与HT29细胞相比,地塞米松(DEX)处理导致T84细胞的增殖和侵袭增加。DEX处理诱导CDK1表达,伴随CDK1甲基化降低,表明表观遗传调控。GR的消耗抑制了转移性结肠癌细胞的增殖,而CDK1的消耗对转移性癌细胞的增殖和侵袭具有相似的抑制作用。我们的研究表明,糖皮质激素-GR-CDK1信号会诱导结肠癌细胞的增殖和侵袭,涉及使用糖皮质激素的疗法需要谨慎和重新评估。与HT29细胞相比,地塞米松(DEX)处理导致T84细胞的增殖和侵袭增加。DEX处理诱导CDK1表达,伴随CDK1甲基化降低,表明表观遗传调控。GR的消耗抑制了转移性结肠癌细胞的增殖,而CDK1的消耗对转移性癌细胞的增殖和侵袭具有相似的抑制作用。我们的研究表明,糖皮质激素-GR-CDK1信号会诱导结肠癌细胞的增殖和侵袭,涉及使用糖皮质激素的疗法需要谨慎和重新评估。GR的消耗抑制了转移性结肠癌细胞的增殖,而CDK1的消耗对转移性癌细胞的增殖和侵袭具有相似的抑制作用。我们的研究表明,糖皮质激素-GR-CDK1信号会诱导结肠癌细胞的增殖和侵袭,涉及使用糖皮质激素的疗法需要谨慎和重新评估。GR的消耗抑制了转移性结肠癌细胞的增殖,而CDK1的消耗对转移性癌细胞的增殖和侵袭具有相似的抑制作用。我们的研究表明,糖皮质激素-GR-CDK1信号会诱导结肠癌细胞的增殖和侵袭,涉及使用糖皮质激素的疗法需要谨慎和重新评估。





















































 京公网安备 11010802027423号
京公网安备 11010802027423号