当前位置:
X-MOL 学术
›
J. Phys. Chem. B
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Decoding Collagen Triple Helix Stability by Means of Hybrid DFT Simulations.
The Journal of Physical Chemistry B ( IF 2.8 ) Pub Date : 2019-08-14 , DOI: 10.1021/acs.jpcb.9b05222 Michele Cutini 1 , Massimo Bocus 1 , Piero Ugliengo 1
The Journal of Physical Chemistry B ( IF 2.8 ) Pub Date : 2019-08-14 , DOI: 10.1021/acs.jpcb.9b05222 Michele Cutini 1 , Massimo Bocus 1 , Piero Ugliengo 1
Affiliation
|
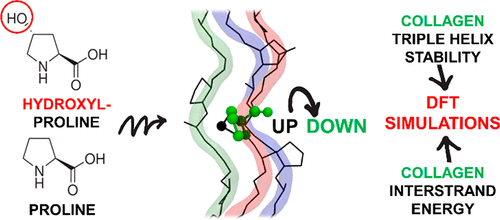
Collagen is a protein family defined by a triple helix motif, which comprises roughly one-third of the total human protein content. Decoding the reasons underlying the stability of the collagen triple helix is of both fundamental and applicative relevance, for instance, to guide collagen protein engineering. In principle, full quantum mechanical approaches based on density functional theory (DFT) are ideal to study the subtle physicochemical features of collagen. Unfortunately, the huge size of the protein prevents the straightforward application of DFT to realistic collagen protein models. In this paper, we propose a new realistic model of the collagen protein based on a periodic approach. The protein model exploits the intrinsic symmetry of the collagen triple helix, dramatically lowering the cost of the simulations. This allows using accurate hybrid DFT simulations (B3LYP-D/TZP) for systematic studies of the collagen protein features. We have tested the proposed model/level-of-theory combination to analyze the well-known proline-conformation/collagen-stability relationship. For this purpose, we have performed an extensive conformational analysis of the proline ring within the protein, clarifying some of the reasons linking specific ring conformations to helix positions. Throughout our data analysis, we have also obtained "for free" the collagen interstrand binding energy. Simulation results demonstrate that London dispersion interactions play a dominant role in the whole helix stability. The good agreement with the experimental data validates the use of the proposed model/level of theory to assist the active field of collagen-like peptide synthesis.
中文翻译:

通过混合DFT模拟对胶原三螺旋稳定性进行解码。
胶原蛋白是由三重螺旋基序定义的蛋白质家族,其约占人类总蛋白质含量的三分之一。解释胶原三螺旋体稳定性的根本原因具有根本和应用相关性,例如,以指导胶原蛋白工程化。原则上,基于密度泛函理论(DFT)的全量子力学方法是研究胶原蛋白微妙的理化特征的理想选择。不幸的是,蛋白质的巨大尺寸阻止了DFT直接应用于现实的胶原蛋白模型。在本文中,我们基于周期性方法提出了一种新的胶原蛋白现实模型。蛋白质模型利用了胶原蛋白三螺旋的内在对称性,大大降低了仿真成本。这允许使用精确的混合DFT模拟(B3LYP-D / TZP)对胶原蛋白特征进行系统研究。我们已经测试了所提出的模型/理论水平的组合,以分析众所周知的脯氨酸构象/胶原-稳定性关系。为此,我们对蛋白质中的脯氨酸环进行了广泛的构象分析,阐明了将特定的环构象与螺旋位置联系起来的一些原因。在整个数据分析中,我们还“免费”获得了胶原蛋白链间结合能。仿真结果表明,伦敦色散相互作用在整个螺旋稳定性中起主导作用。与实验数据的良好一致性验证了所提出的模型/理论水平在胶原样肽合成活性领域的应用。
更新日期:2019-08-15
中文翻译:

通过混合DFT模拟对胶原三螺旋稳定性进行解码。
胶原蛋白是由三重螺旋基序定义的蛋白质家族,其约占人类总蛋白质含量的三分之一。解释胶原三螺旋体稳定性的根本原因具有根本和应用相关性,例如,以指导胶原蛋白工程化。原则上,基于密度泛函理论(DFT)的全量子力学方法是研究胶原蛋白微妙的理化特征的理想选择。不幸的是,蛋白质的巨大尺寸阻止了DFT直接应用于现实的胶原蛋白模型。在本文中,我们基于周期性方法提出了一种新的胶原蛋白现实模型。蛋白质模型利用了胶原蛋白三螺旋的内在对称性,大大降低了仿真成本。这允许使用精确的混合DFT模拟(B3LYP-D / TZP)对胶原蛋白特征进行系统研究。我们已经测试了所提出的模型/理论水平的组合,以分析众所周知的脯氨酸构象/胶原-稳定性关系。为此,我们对蛋白质中的脯氨酸环进行了广泛的构象分析,阐明了将特定的环构象与螺旋位置联系起来的一些原因。在整个数据分析中,我们还“免费”获得了胶原蛋白链间结合能。仿真结果表明,伦敦色散相互作用在整个螺旋稳定性中起主导作用。与实验数据的良好一致性验证了所提出的模型/理论水平在胶原样肽合成活性领域的应用。

































 京公网安备 11010802027423号
京公网安备 11010802027423号