当前位置:
X-MOL 学术
›
Exp. Mol. Med.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
SPIN90, an adaptor protein, alters the proximity between Rab5 and Gapex5 and facilitates Rab5 activation during EGF endocytosis.
Experimental & Molecular Medicine ( IF 9.5 ) Pub Date : 2019-07-29 , DOI: 10.1038/s12276-019-0284-5 Hwan Kim 1 , Hyejin Oh 1 , Young Soo Oh 1 , Jeomil Bae 2 , Nan Hyung Hong 3 , Su Jung Park 1 , Suyeon Ahn 1 , Miriam Lee 1 , Sangmyung Rhee 4 , Sung Haeng Lee 5 , Youngsoo Jun 1 , Sung Hyun Kim 6 , Yun Hyun Huh 1 , Woo Keun Song 1
Experimental & Molecular Medicine ( IF 9.5 ) Pub Date : 2019-07-29 , DOI: 10.1038/s12276-019-0284-5 Hwan Kim 1 , Hyejin Oh 1 , Young Soo Oh 1 , Jeomil Bae 2 , Nan Hyung Hong 3 , Su Jung Park 1 , Suyeon Ahn 1 , Miriam Lee 1 , Sangmyung Rhee 4 , Sung Haeng Lee 5 , Youngsoo Jun 1 , Sung Hyun Kim 6 , Yun Hyun Huh 1 , Woo Keun Song 1
Affiliation
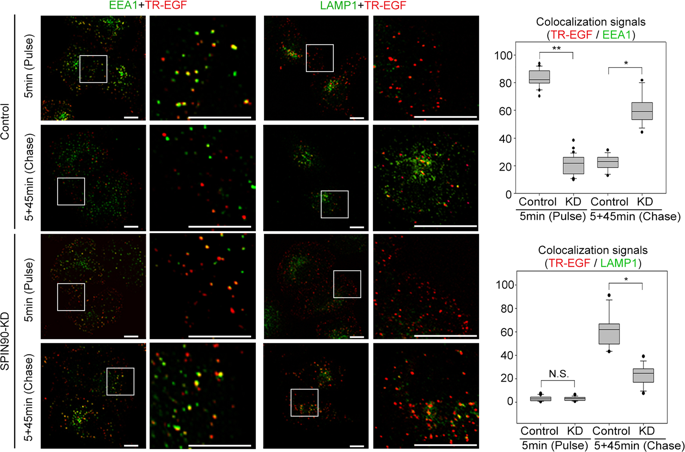
|
During ligand-mediated receptor endocytosis, the small GTPase Rab5 functions in vesicle fusion and trafficking. Rab5 activation is known to require interactions with its guanine nucleotide-exchange factors (GEFs); however, the mechanism regulating Rab5 interactions with GEFs remains unclear. Here, we show that the SH3-adapter protein SPIN90 participates in the activation of Rab5 through the recruitment of both Rab5 and its GEF, Gapex5, to endosomal membranes during epidermal growth factor (EGF)-mediated endocytosis. SPIN90 strongly interacts with the inactive Rab5/GDI2 complex through its C-terminus. In response to EGF signaling, extracellular signal-regulated kinase (ERK)-mediated phosphorylation of SPIN90 at Thr-242 enables SPIN90 to bind Gapex5 through its N-terminal SH3 domain. Gapex5 is a determinant of Rab5 membrane targeting, while SPIN90 mediates the interaction between Gapex5 and Rab5 in a phosphorylation-dependent manner. Collectively, our findings suggest that SPIN90, as an adaptor protein, simultaneously binds inactive Rab5 and Gapex5, thereby altering their spatial proximity and facilitating Rab5 activation.
中文翻译:

SPIN90 是一种衔接蛋白,可改变 Rab5 和 Gapex5 之间的接近程度,并在 EGF 内吞作用期间促进 Rab5 激活。
在配体介导的受体内吞作用过程中,小 GTP 酶 Rab5 在囊泡融合和运输中发挥作用。已知 Rab5 激活需要与其鸟嘌呤核苷酸交换因子 (GEF) 相互作用;然而,调节 Rab5 与 GEF 相互作用的机制仍不清楚。在这里,我们表明 SH3 衔接蛋白 SPIN90 通过在表皮生长因子 (EGF) 介导的内吞作用期间将 Rab5 及其 GEF Gapex5 募集到内体膜来参与 Rab5 的激活。SPIN90 通过其 C 端与非活性 Rab5/GDI2 复合物强烈相互作用。响应 EGF 信号,细胞外信号调节激酶 (ERK) 介导的 SPIN90 在 Thr-242 处的磷酸化使 SPIN90 能够通过其 N 末端 SH3 结构域结合 Gapex5。Gapex5 是 Rab5 膜靶向的决定因素,而 SPIN90 以磷酸化依赖的方式介导 Gapex5 和 Rab5 之间的相互作用。总的来说,我们的研究结果表明 SPIN90 作为衔接蛋白同时结合无活性的 Rab5 和 Gapex5,从而改变它们的空间接近度并促进 Rab5 激活。
更新日期:2019-07-29
中文翻译:

SPIN90 是一种衔接蛋白,可改变 Rab5 和 Gapex5 之间的接近程度,并在 EGF 内吞作用期间促进 Rab5 激活。
在配体介导的受体内吞作用过程中,小 GTP 酶 Rab5 在囊泡融合和运输中发挥作用。已知 Rab5 激活需要与其鸟嘌呤核苷酸交换因子 (GEF) 相互作用;然而,调节 Rab5 与 GEF 相互作用的机制仍不清楚。在这里,我们表明 SH3 衔接蛋白 SPIN90 通过在表皮生长因子 (EGF) 介导的内吞作用期间将 Rab5 及其 GEF Gapex5 募集到内体膜来参与 Rab5 的激活。SPIN90 通过其 C 端与非活性 Rab5/GDI2 复合物强烈相互作用。响应 EGF 信号,细胞外信号调节激酶 (ERK) 介导的 SPIN90 在 Thr-242 处的磷酸化使 SPIN90 能够通过其 N 末端 SH3 结构域结合 Gapex5。Gapex5 是 Rab5 膜靶向的决定因素,而 SPIN90 以磷酸化依赖的方式介导 Gapex5 和 Rab5 之间的相互作用。总的来说,我们的研究结果表明 SPIN90 作为衔接蛋白同时结合无活性的 Rab5 和 Gapex5,从而改变它们的空间接近度并促进 Rab5 激活。































 京公网安备 11010802027423号
京公网安备 11010802027423号