当前位置:
X-MOL 学术
›
Mol. Pharmaceutics
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
用温度扫描粘度计探测蛋白质的热稳定性。
Molecular Pharmaceutics ( IF 4.5 ) Pub Date : 2019-07-25 , DOI: 10.1021/acs.molpharmaceut.9b00598
Bowen Jiang 1 , Amita Jain 1 , Yuwei Lu 1 , Stephen W Hoag 1
Molecular Pharmaceutics ( IF 4.5 ) Pub Date : 2019-07-25 , DOI: 10.1021/acs.molpharmaceut.9b00598
Bowen Jiang 1 , Amita Jain 1 , Yuwei Lu 1 , Stephen W Hoag 1
Affiliation
|
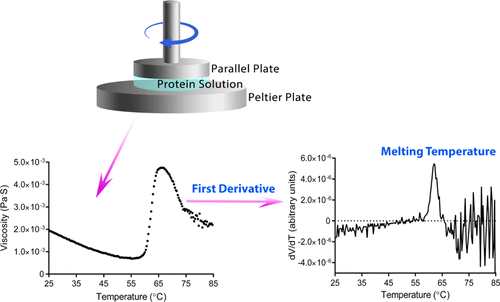
热稳定性对于理解蛋白质的稳定性至关重要,并且是治疗生物制剂(包括酶,融合蛋白,单克隆抗体等)的关键质量属性。常用的分析方法,例如差示扫描量热法(DSC),差示扫描荧光法( DSF)和圆二色性(CD)在测量蛋白质热稳定性方面有其局限性。通过这项工作,我们描述了一种使用温度扫描粘度计探测各种配方中蛋白质热稳定性的新颖方法。将材料的粘度相对于温度作图,并且该粘度相对于温度的一阶导数的峰显示出与蛋白质解链温度相关。在磷酸盐缓冲液中以1 mg / mL的浓度测量的牛血清白蛋白(BSA)的解链温度为63°C,接近于DSC获得的64°C值。BSA的展开是使用二阶紫外可见光谱(UV-vis)和动态光散射(DLS)的正交技术确认的。该方法还能够揭示蛋白质的微环境变化,包括制剂效应。还使用此方法测试了其他多个结构域的蛋白质,包括溶菌酶和IgG,并显示了与DSC相当的解链温度。这项工作表明了使用温度扫描粘度计来测量具有更宽蛋白质浓度范围的各种配方基质中蛋白质的热稳定性的可行性。它接近于DSC获得的64°C的值。使用正交二阶紫外可见光谱(UV-vis)和动态光散射(DLS)的正交技术确认了BSA的展开。该方法还能够揭示蛋白质的微环境变化,包括制剂效应。还使用此方法测试了其他多个结构域的蛋白质,包括溶菌酶和IgG,并显示了与DSC相当的解链温度。这项工作表明了使用温度扫描粘度计来测量具有更宽蛋白质浓度范围的各种配方基质中蛋白质的热稳定性的可行性。它接近于DSC获得的64°C的值。BSA的展开是使用二阶紫外可见光谱(UV-vis)和动态光散射(DLS)的正交技术确认的。该方法还能够揭示蛋白质的微环境变化,包括制剂效应。还使用此方法测试了其他多个结构域的蛋白质,包括溶菌酶和IgG,并显示了与DSC相当的解链温度。这项工作表明了使用温度扫描粘度计来测量具有更宽蛋白质浓度范围的各种配方基质中蛋白质的热稳定性的可行性。该方法还能够揭示蛋白质的微环境变化,包括制剂效应。还使用此方法测试了其他多个结构域的蛋白质,包括溶菌酶和IgG,并显示了与DSC相当的解链温度。这项工作表明了使用温度扫描粘度计来测量具有更宽蛋白质浓度范围的各种配方基质中蛋白质的热稳定性的可行性。该方法还能够揭示蛋白质的微环境变化,包括制剂效应。还使用此方法测试了其他多个结构域的蛋白质,包括溶菌酶和IgG,并显示了与DSC相当的解链温度。这项工作表明了使用温度扫描粘度计来测量具有更宽蛋白质浓度范围的各种配方基质中蛋白质的热稳定性的可行性。

"点击查看英文标题和摘要"
更新日期:2019-07-15

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号