当前位置:
X-MOL 学术
›
Chem. Sci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Investigation of GTP-dependent dimerization of G12X K-Ras variants using ultraviolet photodissociation mass spectrometry.
Chemical Science ( IF 7.6 ) Pub Date : 2019-07-15 , DOI: 10.1039/c9sc01032g M Rachel Mehaffey 1 , Christopher L Schardon 2 , Elisa T Novelli 1 , Michael B Cammarata 1 , Lauren J Webb 1 , Walter Fast 2 , Jennifer S Brodbelt 1
Chemical Science ( IF 7.6 ) Pub Date : 2019-07-15 , DOI: 10.1039/c9sc01032g M Rachel Mehaffey 1 , Christopher L Schardon 2 , Elisa T Novelli 1 , Michael B Cammarata 1 , Lauren J Webb 1 , Walter Fast 2 , Jennifer S Brodbelt 1
Affiliation
|
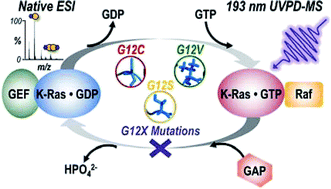
Mutations in the GTPase enzyme K-Ras, specifically at codon G12, remain the most common genetic alterations in human cancers. The mechanisms governing activation of downstream signaling pathways and how they relate back to the identity of the mutation have yet to be completely defined. Here we use native mass spectrometry (MS) combined with ultraviolet photodissociation (UVPD) to investigate the impact of three G12X mutations (G12C, G12V, G12S) on the homodimerization of K-Ras as well as heterodimerization with a downstream effector protein, Raf. Electrospray ionization (ESI) was used to transfer complexes of WT or G12X K-Ras bound to guanosine 5'-diphosphate (GDP) or GppNHp (non-hydrolyzable analogue of GTP) into the gas phase. Relative abundances of homo- or hetero-dimer complexes were estimated from ESI-MS spectra. K-Ras + Raf heterocomplexes were activated with UVPD to probe structural changes responsible for observed differences in the amount of heterocomplex formed for each variant. Holo (ligand-bound) fragment ions resulting from photodissociation suggest the G12X mutants bind Raf along the expected effector binding region (β-interface) but may interact with Raf via an alternative α-interface as well. Variations in backbone cleavage efficiencies during UV photoactivation of each variant were used to relate mutation identity to structural changes that might impact downstream signaling. Specifically, oncogenic upregulation for hydrogen-bonding amino acid substitutions (G12C, G12S) is achieved by stabilizing β-interface interactions with Raf, while a bulkier, hydrophobic G12V substitution leads to destabilization of this interface and instead increases the proximity of residues along the α-helical bundles. This study deciphers new pieces of the complex puzzle of how different K-Ras mutations exert influence in downstream signaling.
中文翻译:

使用紫外光解离质谱法研究 G12X K-Ras 变体的 GTP 依赖性二聚化。
GTP 酶 K-Ras 的突变,特别是密码子 G12 的突变,仍然是人类癌症中最常见的遗传改变。控制下游信号通路激活的机制以及它们与突变身份的关系尚未完全确定。在这里,我们使用天然质谱 (MS) 结合紫外光解离 (UVPD) 来研究三种 G12X 突变(G12C、G12V、G12S)对 K-Ras 的同二聚化以及与下游效应蛋白 Raf 的异二聚化的影响。使用电喷雾电离 (ESI) 将与 5'-二磷酸鸟苷 (GDP) 或 GppNHp(GTP 的不可水解类似物)结合的 WT 或 G12X K-Ras 复合物转移到气相中。根据 ESI-MS 谱估计同源或异源二聚体复合物的相对丰度。用 UVPD 激活 K-Ras + Raf 异质复合物,以探测导致每个变体形成的异质复合物数量差异的结构变化。光解离产生的 Holo(配体结合)碎片离子表明 G12X 突变体沿着预期的效应器结合区域(β 界面)结合 Raf,但也可能通过替代的 α 界面与 Raf 相互作用。每个变体的紫外光激活过程中主链裂解效率的变化被用来将突变身份与可能影响下游信号传导的结构变化联系起来。具体来说,氢键氨基酸取代(G12C、G12S)的致癌上调是通过稳定与 Raf 的 β 界面相互作用来实现的,而体积更大的疏水性 G12V 取代会导致该界面不稳定,反而增加了 α 上残基的接近度。 -螺旋束。 这项研究破解了不同 K-Ras 突变如何影响下游信号转导的复杂难题的新部分。
更新日期:2019-07-15
中文翻译:

使用紫外光解离质谱法研究 G12X K-Ras 变体的 GTP 依赖性二聚化。
GTP 酶 K-Ras 的突变,特别是密码子 G12 的突变,仍然是人类癌症中最常见的遗传改变。控制下游信号通路激活的机制以及它们与突变身份的关系尚未完全确定。在这里,我们使用天然质谱 (MS) 结合紫外光解离 (UVPD) 来研究三种 G12X 突变(G12C、G12V、G12S)对 K-Ras 的同二聚化以及与下游效应蛋白 Raf 的异二聚化的影响。使用电喷雾电离 (ESI) 将与 5'-二磷酸鸟苷 (GDP) 或 GppNHp(GTP 的不可水解类似物)结合的 WT 或 G12X K-Ras 复合物转移到气相中。根据 ESI-MS 谱估计同源或异源二聚体复合物的相对丰度。用 UVPD 激活 K-Ras + Raf 异质复合物,以探测导致每个变体形成的异质复合物数量差异的结构变化。光解离产生的 Holo(配体结合)碎片离子表明 G12X 突变体沿着预期的效应器结合区域(β 界面)结合 Raf,但也可能通过替代的 α 界面与 Raf 相互作用。每个变体的紫外光激活过程中主链裂解效率的变化被用来将突变身份与可能影响下游信号传导的结构变化联系起来。具体来说,氢键氨基酸取代(G12C、G12S)的致癌上调是通过稳定与 Raf 的 β 界面相互作用来实现的,而体积更大的疏水性 G12V 取代会导致该界面不稳定,反而增加了 α 上残基的接近度。 -螺旋束。 这项研究破解了不同 K-Ras 突变如何影响下游信号转导的复杂难题的新部分。































 京公网安备 11010802027423号
京公网安备 11010802027423号