当前位置:
X-MOL 学术
›
Angew. Chem. Int. Ed.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Conditional Singlet Oxygen Generation through a Bioorthogonal DNA-targeted Tetrazine Reaction.
Angewandte Chemie International Edition ( IF 16.1 ) Pub Date : 2019-08-12 , DOI: 10.1002/anie.201907093
Greta Linden 1 , Lei Zhang 1 , Fabian Pieck 1 , Uwe Linne 1 , Dmitri Kosenkov 2 , Ralf Tonner 1 , Olalla Vázquez 1
Angewandte Chemie International Edition ( IF 16.1 ) Pub Date : 2019-08-12 , DOI: 10.1002/anie.201907093
Greta Linden 1 , Lei Zhang 1 , Fabian Pieck 1 , Uwe Linne 1 , Dmitri Kosenkov 2 , Ralf Tonner 1 , Olalla Vázquez 1
Affiliation
|
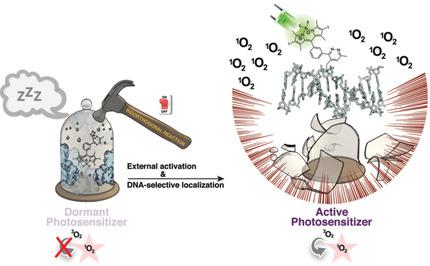
We report the use of bioorthogonal reactions as an original strategy in photodynamic therapy to achieve conditional phototoxicity and specific subcellular localization simultaneously. Our novel halogenated BODIPY-tetrazine probes only become efficient photosensitizers (ΦΔ ≈0.50) through an intracellular inverse-electron-demand Diels-Alder reaction with a suitable dienophile. Ab initio computations reveal an activation-dependent change in decay channels that controls 1 O2 generation. Our bioorthogonal approach also enables spatial control. As a proof-of-concept, we demonstrate the feasibility of the selective activation of our dormant photosensitizer in cellular nuclei, causing cancer cell death upon irradiation. Thus, our dual biorthogonal, activatable photosensitizers open new venues to combat current limitations of photodynamic therapy.
中文翻译:

通过生物正交DNA靶向的四嗪反应有条件的单线态氧生成。
我们报告了使用生物正交反应作为光动力疗法中的原始策略,以同时实现条件光毒性和特定亚细胞定位。我们的新型卤化BODIPY-四嗪探针仅能通过细胞内反电子需求的Diels-Alder反应与合适的亲二烯体反应,成为有效的光敏剂(ΦΔ≈0.50)。从头算算得出,衰变通道中依赖于激活的变化可控制1 O2的产生。我们的生物正交方法还可以实现空间控制。作为概念验证,我们证明了在细胞核中选择性激活我们休眠的光敏剂的可行性,从而在辐射后导致癌细胞死亡。因此,我们的双生物正交,可活化光敏剂开辟了新的场所,以应对当前光动力疗法的局限性。
更新日期:2019-08-12
中文翻译:

通过生物正交DNA靶向的四嗪反应有条件的单线态氧生成。
我们报告了使用生物正交反应作为光动力疗法中的原始策略,以同时实现条件光毒性和特定亚细胞定位。我们的新型卤化BODIPY-四嗪探针仅能通过细胞内反电子需求的Diels-Alder反应与合适的亲二烯体反应,成为有效的光敏剂(ΦΔ≈0.50)。从头算算得出,衰变通道中依赖于激活的变化可控制1 O2的产生。我们的生物正交方法还可以实现空间控制。作为概念验证,我们证明了在细胞核中选择性激活我们休眠的光敏剂的可行性,从而在辐射后导致癌细胞死亡。因此,我们的双生物正交,可活化光敏剂开辟了新的场所,以应对当前光动力疗法的局限性。

































 京公网安备 11010802027423号
京公网安备 11010802027423号