Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
IKKα激酶调节DNA损伤反应并驱动癌症的化学耐药性。
Molecular Cell ( IF 14.5 ) Pub Date : 2019-07-10 , DOI: 10.1016/j.molcel.2019.05.036
Carlota Colomer 1 , Pol Margalef 2 , Alberto Villanueva 3 , Anna Vert 1 , Irene Pecharroman 1 , Laura Solé 1 , Mónica González-Farré 4 , Josune Alonso 1 , Clara Montagut 5 , Maria Martinez-Iniesta 3 , Joan Bertran 6 , Eva Borràs 7 , Mar Iglesias 4 , Eduard Sabidó 7 , Anna Bigas 1 , Simon J Boulton 8 , Lluís Espinosa 1
Molecular Cell ( IF 14.5 ) Pub Date : 2019-07-10 , DOI: 10.1016/j.molcel.2019.05.036
Carlota Colomer 1 , Pol Margalef 2 , Alberto Villanueva 3 , Anna Vert 1 , Irene Pecharroman 1 , Laura Solé 1 , Mónica González-Farré 4 , Josune Alonso 1 , Clara Montagut 5 , Maria Martinez-Iniesta 3 , Joan Bertran 6 , Eva Borràs 7 , Mar Iglesias 4 , Eduard Sabidó 7 , Anna Bigas 1 , Simon J Boulton 8 , Lluís Espinosa 1
Affiliation
|
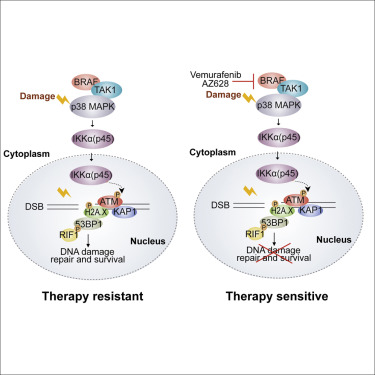
磷酸化的IKKα(p45)是IKKα激酶的核活性形式,由MAP激酶BRAF和TAK1诱导,并促进肿瘤的生长,独立于经典的NF-κB信号传导。对IKKα(p45)激活的来源及其在核中下游底物的见解仍有待确定。在这里,我们发现IKKα(p45)被DNA损伤快速激活,而不受ATM-ATR的依赖,但依赖于BRAF-TAK1-p38-MAPK,并且对于强大的ATM激活和有效的DNA修复是必需的。取消BRAF或IKKα活性会减弱ATM,Chk1,MDC1,Kap1和53BP1的磷酸化,损害53BP1和RIF1共同招募至DNA损伤部位,并抑制功能失调的端粒的53BP1依赖性融合。此外,IKKα或BRAF抑制协同增强了5-FU和伊立替康在体内根除化疗耐药的转移性人类肿瘤的治疗潜力。我们的结果将DDR中的BRAF和IKKα激酶包含在内,并揭示了癌症治疗的联合策略。

"点击查看英文标题和摘要"
更新日期:2019-07-10

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号