当前位置:
X-MOL 学术
›
Nat. Chem. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Covalent targeting of the vacuolar H+-ATPase activates autophagy via mTORC1 inhibition.
Nature Chemical Biology ( IF 12.9 ) Pub Date : 2019-07-08 , DOI: 10.1038/s41589-019-0308-4 Clive Yik-Sham Chung 1, 2 , Hijai R Shin 3, 4 , Charles A Berdan 5 , Breanna Ford 5 , Carl C Ward 2, 3 , James A Olzmann 5 , Roberto Zoncu 3, 4 , Daniel K Nomura 1, 2, 3, 5
Nature Chemical Biology ( IF 12.9 ) Pub Date : 2019-07-08 , DOI: 10.1038/s41589-019-0308-4 Clive Yik-Sham Chung 1, 2 , Hijai R Shin 3, 4 , Charles A Berdan 5 , Breanna Ford 5 , Carl C Ward 2, 3 , James A Olzmann 5 , Roberto Zoncu 3, 4 , Daniel K Nomura 1, 2, 3, 5
Affiliation
|
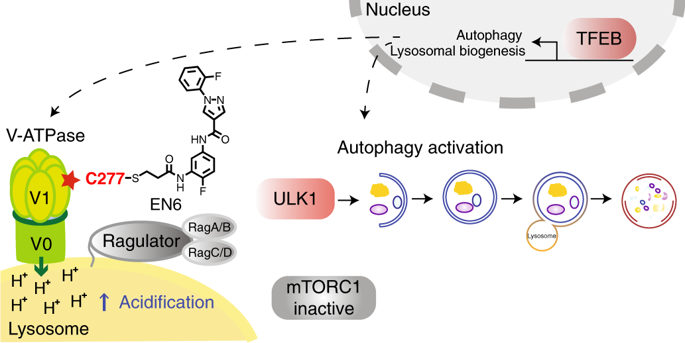
Autophagy is a lysosomal degradation pathway that eliminates aggregated proteins and damaged organelles to maintain cellular homeostasis. A major route for activating autophagy involves inhibition of the mTORC1 kinase, but current mTORC1-targeting compounds do not allow complete and selective mTORC1 blockade. Here, we have coupled screening of a covalent ligand library with activity-based protein profiling to discover EN6, a small-molecule in vivo activator of autophagy that covalently targets cysteine 277 in the ATP6V1A subunit of the lysosomal v-ATPase, which activates mTORC1 via the Rag guanosine triphosphatases. EN6-mediated ATP6V1A modification decouples the v-ATPase from the Rags, leading to inhibition of mTORC1 signaling, increased lysosomal acidification and activation of autophagy. Consistently, EN6 clears TDP-43 aggregates, a causative agent in frontotemporal dementia, in a lysosome-dependent manner. Our results provide insight into how the v-ATPase regulates mTORC1, and reveal a unique approach for enhancing cellular clearance based on covalent inhibition of lysosomal mTORC1 signaling.
中文翻译:

共价靶向液泡 H+-ATP 酶可通过抑制 mTORC1 激活自噬。
自噬是一种溶酶体降解途径,可消除聚集的蛋白质和受损的细胞器以维持细胞稳态。激活自噬的主要途径涉及抑制 mTORC1 激酶,但目前的 mTORC1 靶向化合物不允许完全且选择性地阻断 mTORC1。在这里,我们将共价配体库的筛选与基于活性的蛋白质分析结合起来,发现 EN6,一种小分子体内自噬激活剂,共价靶向溶酶体 v-ATP 酶 ATP6V1A 亚基中的半胱氨酸 277,通过该酶激活 mTORC1拉格鸟苷三磷酸酶。EN6 介导的 ATP6V1A 修饰使 v-ATPase 与 Rags 解偶联,从而抑制 mTORC1 信号传导、增加溶酶体酸化和激活自噬。一致地,EN6 以溶酶体依赖性方式清除 TDP-43 聚集物,这是额颞叶痴呆的致病因子。我们的结果深入了解了 v-ATPase 如何调节 mTORC1,并揭示了一种基于溶酶体 mTORC1 信号共价抑制来增强细胞清除的独特方法。
更新日期:2019-07-09
中文翻译:

共价靶向液泡 H+-ATP 酶可通过抑制 mTORC1 激活自噬。
自噬是一种溶酶体降解途径,可消除聚集的蛋白质和受损的细胞器以维持细胞稳态。激活自噬的主要途径涉及抑制 mTORC1 激酶,但目前的 mTORC1 靶向化合物不允许完全且选择性地阻断 mTORC1。在这里,我们将共价配体库的筛选与基于活性的蛋白质分析结合起来,发现 EN6,一种小分子体内自噬激活剂,共价靶向溶酶体 v-ATP 酶 ATP6V1A 亚基中的半胱氨酸 277,通过该酶激活 mTORC1拉格鸟苷三磷酸酶。EN6 介导的 ATP6V1A 修饰使 v-ATPase 与 Rags 解偶联,从而抑制 mTORC1 信号传导、增加溶酶体酸化和激活自噬。一致地,EN6 以溶酶体依赖性方式清除 TDP-43 聚集物,这是额颞叶痴呆的致病因子。我们的结果深入了解了 v-ATPase 如何调节 mTORC1,并揭示了一种基于溶酶体 mTORC1 信号共价抑制来增强细胞清除的独特方法。















































 京公网安备 11010802027423号
京公网安备 11010802027423号