当前位置:
X-MOL 学术
›
Chemosphere
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
微囊藻毒素酶活性可生物降解微囊藻毒素-LR的结构基础。
Chemosphere ( IF 8.1 ) Pub Date : 2019-07-02 , DOI: 10.1016/j.chemosphere.2019.07.012 Qianqian Xu 1 , Jinhui Fan 1 , Hai Yan 1 , Shahbaz Ahmad 1 , Zhenzhen Zhao 1 , Chunhua Yin 1 , Xiaolu Liu 1 , Yang Liu 1 , Haiyang Zhang 1
Chemosphere ( IF 8.1 ) Pub Date : 2019-07-02 , DOI: 10.1016/j.chemosphere.2019.07.012 Qianqian Xu 1 , Jinhui Fan 1 , Hai Yan 1 , Shahbaz Ahmad 1 , Zhenzhen Zhao 1 , Chunhua Yin 1 , Xiaolu Liu 1 , Yang Liu 1 , Haiyang Zhang 1
Affiliation
|
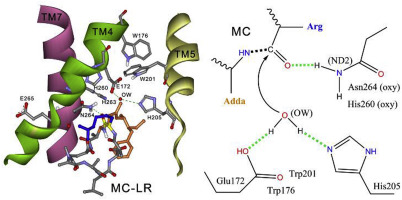
微囊藻毒素酶(MlrA)催化从蓝细菌细胞产生和释放的肝毒性微囊藻毒素-LR(MC-LR)的第一个也是最重要的生物降解步骤,其潜在的催化机理尚未完全明了。先前假定MlrA是具有H260AIH263NE265的活性位点的金属蛋白酶,H260AIH263NE265是HEXXH的常见金属结合基序的变体。通过与含HEXXH的金属蛋白酶中的代表性模式进行比较,分子动力学模拟,同源性建模和对接,Sphingomonas sp。参与MC-LR生物降解的MlrA活性位点。预计USTB-05。然后构建MlrA的定点突变体用于验证。结果表明,MlrA可能不是金属蛋白酶,而是属于II型CAAX异戊二烯基内肽酶的谷氨酸蛋白酶。结合MlrA及其突变体对MC-LR的生物降解,提出了MlrA对MC-LR生物降解的完整酶促机制:Glu172和His205激活水分子,促进亲核攻击MC-LR的Adda-Arg肽键; Trp176和Trp201与Glu172的羧酸酯侧链接触,并通过潜在地提高其pKa来加快反应速率;His260和Asn264(位于先前假定的H260AIH263NE265的活动中心)用作氧阴离子孔,以稳定过渡态。这项研究揭示了代表性的模式和定点诱变实验中的MlrA催化MC-LR的酶机制。Glu172和His205激活水分子,促进对MC-LR的Adda-Arg肽键的亲核攻击;Trp176和Trp201与Glu172的羧酸酯侧链接触,并通过潜在地提高其pKa来加快反应速率;His260和Asn264(位于先前假定的H260AIH263NE265的活动中心)用作氧阴离子孔,以稳定过渡态。这项研究揭示了代表性的模式和定点诱变实验中的MlrA催化MC-LR的酶机制。Glu172和His205激活水分子,促进对MC-LR的Adda-Arg肽键的亲核攻击;Trp176和Trp201与Glu172的羧酸酯侧链接触,并通过潜在地提高其pKa来加快反应速率;His260和Asn264(位于先前假定的H260AIH263NE265的活动中心)用作氧阴离子孔,以稳定过渡态。这项研究揭示了代表性的模式和定点诱变实验中的MlrA催化MC-LR的酶机制。His260和Asn264(位于先前假定的H260AIH263NE265的活动中心)用作氧阴离子孔,以稳定过渡态。这项研究揭示了代表性的模式和定点诱变实验中的MlrA催化MC-LR的酶机制。His260和Asn264(位于先前假定的H260AIH263NE265的活动中心)用作氧阴离子孔,以稳定过渡态。这项研究揭示了代表性的模式和定点诱变实验中的MlrA催化MC-LR的酶机制。

"点击查看英文标题和摘要"
更新日期:2019-07-03

"点击查看英文标题和摘要"















































 京公网安备 11010802027423号
京公网安备 11010802027423号