当前位置:
X-MOL 学术
›
ACS Appl. Mater. Interfaces
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Tumor Homing Reactive Oxygen Species Nanoparticle for Enhanced Cancer Therapy.
ACS Applied Materials & Interfaces ( IF 8.3 ) Pub Date : 2019-06-25 , DOI: 10.1021/acsami.9b07483 Hyeon-Yeol Cho 1, 2 , Ahmet Mavi 3 , Sy-Tsong Dean Chueng 1 , Thanapat Pongkulapa 1 , Nicholas Pasquale 1 , Hudifah Rabie 1 , Jiyou Han 4 , Jong Hoon Kim 5 , Tae-Hyung Kim 6 , Jeong-Woo Choi 2 , Ki-Bum Lee 1, 7
ACS Applied Materials & Interfaces ( IF 8.3 ) Pub Date : 2019-06-25 , DOI: 10.1021/acsami.9b07483 Hyeon-Yeol Cho 1, 2 , Ahmet Mavi 3 , Sy-Tsong Dean Chueng 1 , Thanapat Pongkulapa 1 , Nicholas Pasquale 1 , Hudifah Rabie 1 , Jiyou Han 4 , Jong Hoon Kim 5 , Tae-Hyung Kim 6 , Jeong-Woo Choi 2 , Ki-Bum Lee 1, 7
Affiliation
|
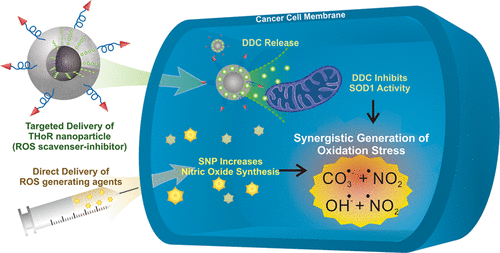
Multifunctional nanoparticles that carry chemotherapeutic agents can be innovative anticancer therapeutic options owing to their tumor-targeting ability and high drug-loading capacity. However, the nonspecific release of toxic DNA-intercalating anticancer drugs from the nanoparticles has significant side effects on healthy cells surrounding the tumors. Herein, we report a tumor homing reactive oxygen species nanoparticle (THoR-NP) platform that is highly effective and selective for ablating malignant tumors. Sodium nitroprusside (SNP) and diethyldithiocarbamate (DDC) were selected as an exogenous reactive oxygen species (ROS) generator and a superoxide dismutase 1 inhibitor, respectively. DDC-loaded THoR-NP, in combination with SNP treatment, eliminated multiple cancer cell lines effectively by the generation of peroxynitrite in the cells (>95% cell death), as compared to control drug treatments of the same concentration of DDC or SNP alone (0% cell death). Moreover, the magnetic core (ZnFe2O4) of the THoR-NP can specifically ablate tumor cells (breast cancer cells) via magnetic hyperthermia, in conjunction with DDC, even in the absence of any exogenous RS supplements. Finally, by incorporating iRGD peptide moieties in the THoR-NP, integrin-enriched cancer cells (malignant tumors, MDA-MB-231) were effectively and selectively killed, as opposed to nonmetastatic tumors (MCF-7), as confirmed in a mouse xenograft model. Hence, our strategy of using nanoparticles embedded with ROS-scavenger-inhibitor with an exogenous ROS supplement is highly selective and effective cancer therapy.
中文翻译:

用于增强癌症治疗的肿瘤归巢活性氧纳米颗粒。
携带化学治疗剂的多功能纳米颗粒由于其靶向肿瘤的能力和高载药量而成为创新的抗癌治疗选择。然而,从纳米颗粒非特异性释放有毒的可插入DNA的抗癌药物对肿瘤周围的健康细胞具有显着的副作用。在这里,我们报告肿瘤归巢活性氧纳米颗粒(THoR-NP)平台,对消融恶性肿瘤是高度有效和选择性的。分别选择硝普钠(SNP)和二乙基二硫代氨基甲酸钠(DDC)作为外源活性氧(ROS)生成剂和超氧化物歧化酶1抑制剂。负载DDC的THoR-NP与SNP处理相结合,通过在细胞中生成过氧亚硝酸盐有效地消除了多种癌细胞系(> 与相同浓度的DDC或SNP单独进行的对照药物治疗相比(95%细胞死亡)(0%细胞死亡)。而且,THoR-NP的磁芯(ZnFe2O4)可以与DDC一起通过磁热疗法特异性消融肿瘤细胞(乳腺癌细胞),即使在没有任何外源性RS补充剂的情况下也是如此。最后,通过将iRGD肽部分掺入THoR-NP中,与非转移性肿瘤(MCF-7)相比,富含整合素的癌细胞(恶性肿瘤,MDA-MB-231)被有效地和选择性地杀死了,这一点在小鼠中得到了证实。异种移植模型。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。与仅相同浓度DDC或SNP的对照药物治疗相比(0%细胞死亡)。此外,THoR-NP的磁芯(ZnFe2O4)可以与DDC一起通过磁热疗法特异性消融肿瘤细胞(乳腺癌细胞),即使在没有任何外源性RS补充剂的情况下也是如此。最后,通过将iRGD肽部分掺入THoR-NP中,与非转移性肿瘤(MCF-7)相比,富含整合素的癌细胞(恶性肿瘤,MDA-MB-231)被有效地和选择性地杀死了,这一点在小鼠中得到了证实。异种移植模型。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。与仅相同浓度DDC或SNP的对照药物治疗相比(0%细胞死亡)。此外,THoR-NP的磁芯(ZnFe2O4)可以与DDC一起通过磁热疗法特异性消融肿瘤细胞(乳腺癌细胞),即使在没有任何外源性RS补充剂的情况下也是如此。最后,通过将iRGD肽部分掺入THoR-NP中,与非转移性肿瘤(MCF-7)相比,富含整合素的癌细胞(恶性肿瘤,MDA-MB-231)得以有效和选择性地被杀死异种移植模型。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。THoR-NP的磁芯(ZnFe2O4)可以与DDC一起通过磁热疗法特异性消融肿瘤细胞(乳腺癌细胞),即使在没有任何外源性RS补充剂的情况下也是如此。最后,通过将iRGD肽部分掺入THoR-NP中,与非转移性肿瘤(MCF-7)相比,富含整合素的癌细胞(恶性肿瘤,MDA-MB-231)得以有效和选择性地被杀死异种移植模型。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。THoR-NP的磁芯(ZnFe2O4)可以与DDC一起通过磁热疗法特异性消融肿瘤细胞(乳腺癌细胞),即使在没有任何外源性RS补充剂的情况下也是如此。最后,通过将iRGD肽部分掺入THoR-NP中,与非转移性肿瘤(MCF-7)相比,富含整合素的癌细胞(恶性肿瘤,MDA-MB-231)得以有效和选择性地被杀死异种移植模型。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。如在小鼠异种移植模型中所证实的,与非转移性肿瘤(MCF-7)相反,MDA-MB-231)被有效且选择性地杀死。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。如在小鼠异种移植模型中所证实的,与非转移性肿瘤(MCF-7)相反,MDA-MB-231)被有效且选择性地杀死。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。
更新日期:2019-06-25
中文翻译:

用于增强癌症治疗的肿瘤归巢活性氧纳米颗粒。
携带化学治疗剂的多功能纳米颗粒由于其靶向肿瘤的能力和高载药量而成为创新的抗癌治疗选择。然而,从纳米颗粒非特异性释放有毒的可插入DNA的抗癌药物对肿瘤周围的健康细胞具有显着的副作用。在这里,我们报告肿瘤归巢活性氧纳米颗粒(THoR-NP)平台,对消融恶性肿瘤是高度有效和选择性的。分别选择硝普钠(SNP)和二乙基二硫代氨基甲酸钠(DDC)作为外源活性氧(ROS)生成剂和超氧化物歧化酶1抑制剂。负载DDC的THoR-NP与SNP处理相结合,通过在细胞中生成过氧亚硝酸盐有效地消除了多种癌细胞系(> 与相同浓度的DDC或SNP单独进行的对照药物治疗相比(95%细胞死亡)(0%细胞死亡)。而且,THoR-NP的磁芯(ZnFe2O4)可以与DDC一起通过磁热疗法特异性消融肿瘤细胞(乳腺癌细胞),即使在没有任何外源性RS补充剂的情况下也是如此。最后,通过将iRGD肽部分掺入THoR-NP中,与非转移性肿瘤(MCF-7)相比,富含整合素的癌细胞(恶性肿瘤,MDA-MB-231)被有效地和选择性地杀死了,这一点在小鼠中得到了证实。异种移植模型。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。与仅相同浓度DDC或SNP的对照药物治疗相比(0%细胞死亡)。此外,THoR-NP的磁芯(ZnFe2O4)可以与DDC一起通过磁热疗法特异性消融肿瘤细胞(乳腺癌细胞),即使在没有任何外源性RS补充剂的情况下也是如此。最后,通过将iRGD肽部分掺入THoR-NP中,与非转移性肿瘤(MCF-7)相比,富含整合素的癌细胞(恶性肿瘤,MDA-MB-231)被有效地和选择性地杀死了,这一点在小鼠中得到了证实。异种移植模型。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。与仅相同浓度DDC或SNP的对照药物治疗相比(0%细胞死亡)。此外,THoR-NP的磁芯(ZnFe2O4)可以与DDC一起通过磁热疗法特异性消融肿瘤细胞(乳腺癌细胞),即使在没有任何外源性RS补充剂的情况下也是如此。最后,通过将iRGD肽部分掺入THoR-NP中,与非转移性肿瘤(MCF-7)相比,富含整合素的癌细胞(恶性肿瘤,MDA-MB-231)得以有效和选择性地被杀死异种移植模型。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。THoR-NP的磁芯(ZnFe2O4)可以与DDC一起通过磁热疗法特异性消融肿瘤细胞(乳腺癌细胞),即使在没有任何外源性RS补充剂的情况下也是如此。最后,通过将iRGD肽部分掺入THoR-NP中,与非转移性肿瘤(MCF-7)相比,富含整合素的癌细胞(恶性肿瘤,MDA-MB-231)得以有效和选择性地被杀死异种移植模型。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。THoR-NP的磁芯(ZnFe2O4)可以与DDC一起通过磁热疗法特异性消融肿瘤细胞(乳腺癌细胞),即使在没有任何外源性RS补充剂的情况下也是如此。最后,通过将iRGD肽部分掺入THoR-NP中,与非转移性肿瘤(MCF-7)相比,富含整合素的癌细胞(恶性肿瘤,MDA-MB-231)得以有效和选择性地被杀死异种移植模型。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。如在小鼠异种移植模型中所证实的,与非转移性肿瘤(MCF-7)相反,MDA-MB-231)被有效且选择性地杀死。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。如在小鼠异种移植模型中所证实的,与非转移性肿瘤(MCF-7)相反,MDA-MB-231)被有效且选择性地杀死。因此,我们使用嵌入有ROS清除剂抑制剂和外源性ROS补充剂的纳米颗粒的策略是高度选择性和有效的癌症治疗方法。















































 京公网安备 11010802027423号
京公网安备 11010802027423号