当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
通过 eIF2α 磷酸化抑制翻译的结构基础。
Nature Communications ( IF 14.7 ) Pub Date : 2019-06-14 , DOI: 10.1038/s41467-019-10606-1 Yuliya Gordiyenko 1 , José Luis Llácer 1, 2 , V Ramakrishnan 1
Nature Communications ( IF 14.7 ) Pub Date : 2019-06-14 , DOI: 10.1038/s41467-019-10606-1 Yuliya Gordiyenko 1 , José Luis Llácer 1, 2 , V Ramakrishnan 1
Affiliation
|
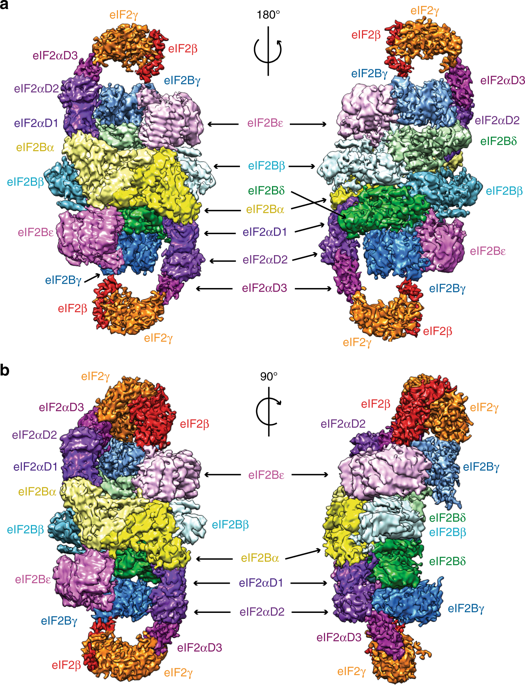
真核细胞对应激的反应之一是通过翻译起始因子 eIF2 的磷酸化来下调蛋白质合成。通过影响 eIF2 与其 GTP-GDP 交换因子 eIF2B 的相互作用,磷酸化导致 eIF2 三元复合物 (eIF2-GTP-tRNAi) 的可用性低。我们已经确定了与磷酸化 eIF2 复合的酵母 eIF2B 的冷冻电镜结构,总分辨率为 4.2 Å。两个 eIF2 分子通过包含磷酸化 Ser51 的 eIF2α-D1 结合 eIF2B 异十聚体的相对两侧。eIF2α-D1主要插入在eIF2B的δ和α亚基的N端螺旋束结构域之间。

"点击查看英文标题和摘要"
更新日期:2019-06-14

"点击查看英文标题和摘要"















































 京公网安备 11010802027423号
京公网安备 11010802027423号