当前位置:
X-MOL 学术
›
Cell Metab.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Transient Receptor Potential V Channels Are Essential for Glucose Sensing by Aldolase and AMPK.
Cell Metabolism ( IF 27.7 ) Pub Date : 2019-06-13 , DOI: 10.1016/j.cmet.2019.05.018 Mengqi Li 1 , Chen-Song Zhang 1 , Yue Zong 1 , Jin-Wei Feng 1 , Teng Ma 1 , Meiqin Hu 2 , Zhizhong Lin 1 , Xiaotong Li 1 , Changchuan Xie 1 , Yaying Wu 1 , Dong Jiang 3 , Ying Li 3 , Cixiong Zhang 1 , Xiao Tian 1 , Wen Wang 4 , Yanyan Yang 5 , Jie Chen 5 , Jiwen Cui 1 , Yu-Qing Wu 1 , Xin Chen 1 , Qing-Feng Liu 1 , Jianfeng Wu 1 , Shu-Yong Lin 1 , Zhiyun Ye 1 , Ying Liu 5 , Hai-Long Piao 4 , Li Yu 3 , Zhuan Zhou 2 , Xiao-Song Xie 6 , D Grahame Hardie 7 , Sheng-Cai Lin 1
Cell Metabolism ( IF 27.7 ) Pub Date : 2019-06-13 , DOI: 10.1016/j.cmet.2019.05.018 Mengqi Li 1 , Chen-Song Zhang 1 , Yue Zong 1 , Jin-Wei Feng 1 , Teng Ma 1 , Meiqin Hu 2 , Zhizhong Lin 1 , Xiaotong Li 1 , Changchuan Xie 1 , Yaying Wu 1 , Dong Jiang 3 , Ying Li 3 , Cixiong Zhang 1 , Xiao Tian 1 , Wen Wang 4 , Yanyan Yang 5 , Jie Chen 5 , Jiwen Cui 1 , Yu-Qing Wu 1 , Xin Chen 1 , Qing-Feng Liu 1 , Jianfeng Wu 1 , Shu-Yong Lin 1 , Zhiyun Ye 1 , Ying Liu 5 , Hai-Long Piao 4 , Li Yu 3 , Zhuan Zhou 2 , Xiao-Song Xie 6 , D Grahame Hardie 7 , Sheng-Cai Lin 1
Affiliation
|
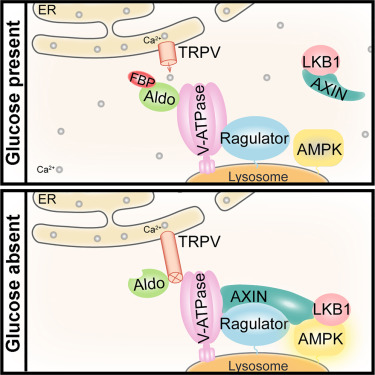
Fructose-1,6-bisphosphate (FBP) aldolase links sensing of declining glucose availability to AMPK activation via the lysosomal pathway. However, how aldolase transmits lack of occupancy by FBP to AMPK activation remains unclear. Here, we show that FBP-unoccupied aldolase interacts with and inhibits endoplasmic reticulum (ER)-localized transient receptor potential channel subfamily V, inhibiting calcium release in low glucose. The decrease of calcium at contact sites between ER and lysosome renders the inhibited TRPV accessible to bind the lysosomal v-ATPase that then recruits AXIN:LKB1 to activate AMPK independently of AMP. Genetic depletion of TRPVs blocks glucose starvation-induced AMPK activation in cells and liver of mice, and in nematodes, indicative of physical requirement of TRPVs. Pharmacological inhibition of TRPVs activates AMPK and elevates NAD+ levels in aged muscles, rejuvenating the animals' running capacity. Our study elucidates that TRPVs relay the FBP-free status of aldolase to the reconfiguration of v-ATPase, leading to AMPK activation in low glucose.
中文翻译:

瞬时受体电位 V 通道对于醛缩酶和 AMPK 的葡萄糖传感至关重要。
1,6-二磷酸果糖 (FBP) 醛缩酶通过溶酶体途径将葡萄糖可用性下降的感知与 AMPK 激活联系起来。然而,醛缩酶如何将 FBP 的占据缺失传递给 AMPK 激活仍不清楚。在这里,我们发现 FBP 未占据的醛缩酶与内质网 (ER) 定位的瞬时受体电位通道亚家族 V 相互作用并抑制,从而抑制低葡萄糖条件下的钙释放。 ER 和溶酶体之间接触位点钙的减少使得受抑制的 TRPV 可与溶酶体 v-ATP 酶结合,然后招募 AXIN:LKB1 独立于 AMP 激活 AMPK。 TRPV 的基因耗竭可阻止小鼠细胞和肝脏以及线虫中葡萄糖饥饿诱导的 AMPK 激活,这表明 TRPV 的物理需求。 TRPV 的药理抑制可激活 AMPK 并提高衰老肌肉中的 NAD+ 水平,从而恢复动物的跑步能力。我们的研究阐明,TRPV 将醛缩酶的无 FBP 状态传递给 v-ATP 酶的重新配置,从而导致低葡萄糖条件下 AMPK 激活。
更新日期:2019-09-30
中文翻译:

瞬时受体电位 V 通道对于醛缩酶和 AMPK 的葡萄糖传感至关重要。
1,6-二磷酸果糖 (FBP) 醛缩酶通过溶酶体途径将葡萄糖可用性下降的感知与 AMPK 激活联系起来。然而,醛缩酶如何将 FBP 的占据缺失传递给 AMPK 激活仍不清楚。在这里,我们发现 FBP 未占据的醛缩酶与内质网 (ER) 定位的瞬时受体电位通道亚家族 V 相互作用并抑制,从而抑制低葡萄糖条件下的钙释放。 ER 和溶酶体之间接触位点钙的减少使得受抑制的 TRPV 可与溶酶体 v-ATP 酶结合,然后招募 AXIN:LKB1 独立于 AMP 激活 AMPK。 TRPV 的基因耗竭可阻止小鼠细胞和肝脏以及线虫中葡萄糖饥饿诱导的 AMPK 激活,这表明 TRPV 的物理需求。 TRPV 的药理抑制可激活 AMPK 并提高衰老肌肉中的 NAD+ 水平,从而恢复动物的跑步能力。我们的研究阐明,TRPV 将醛缩酶的无 FBP 状态传递给 v-ATP 酶的重新配置,从而导致低葡萄糖条件下 AMPK 激活。































 京公网安备 11010802027423号
京公网安备 11010802027423号