Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Molecularly Distinct Clathrin-Coated Pits Differentially Impact EGFR Fate and Signaling.
Cell Reports ( IF 7.5 ) Pub Date : 2019-06-04 , DOI: 10.1016/j.celrep.2019.05.017 Roberta Pascolutti 1 , Veronica Algisi 1 , Alexia Conte 2 , Andrea Raimondi 3 , Mithun Pasham 4 , Srigokul Upadhyayula 5 , Raphael Gaudin 6 , Tanja Maritzen 7 , Elisa Barbieri 2 , Giusi Caldieri 8 , Chiara Tordonato 9 , Stefano Confalonieri 2 , Stefano Freddi 9 , Maria Grazia Malabarba 8 , Elena Maspero 1 , Simona Polo 10 , Carlo Tacchetti 11 , Volker Haucke 7 , Tom Kirchhausen 12 , Pier Paolo Di Fiore 8 , Sara Sigismund 8
Cell Reports ( IF 7.5 ) Pub Date : 2019-06-04 , DOI: 10.1016/j.celrep.2019.05.017 Roberta Pascolutti 1 , Veronica Algisi 1 , Alexia Conte 2 , Andrea Raimondi 3 , Mithun Pasham 4 , Srigokul Upadhyayula 5 , Raphael Gaudin 6 , Tanja Maritzen 7 , Elisa Barbieri 2 , Giusi Caldieri 8 , Chiara Tordonato 9 , Stefano Confalonieri 2 , Stefano Freddi 9 , Maria Grazia Malabarba 8 , Elena Maspero 1 , Simona Polo 10 , Carlo Tacchetti 11 , Volker Haucke 7 , Tom Kirchhausen 12 , Pier Paolo Di Fiore 8 , Sara Sigismund 8
Affiliation
|
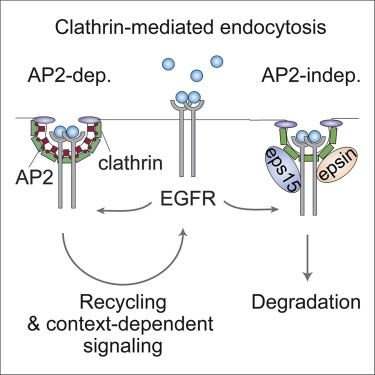
Adaptor protein 2 (AP2) is a major constituent of clathrin-coated pits (CCPs). Whether it is essential for all forms of clathrin-mediated endocytosis (CME) in mammalian cells is an open issue. Here, we demonstrate, by live TIRF microscopy, the existence of a subclass of relatively short-lived CCPs lacking AP2 under physiological, unperturbed conditions. This subclass is retained in AP2-knockout cells and is able to support the internalization of epidermal growth factor receptor (EGFR) but not of transferrin receptor (TfR). The AP2-independent internalization mechanism relies on the endocytic adaptors eps15, eps15L1, and epsin1. The absence of AP2 impairs the recycling of the EGFR to the cell surface, thereby augmenting its degradation. Accordingly, under conditions of AP2 ablation, we detected dampening of EGFR-dependent AKT signaling and cell migration, arguing that distinct classes of CCPs could provide specialized functions in regulating EGFR recycling and signaling.
中文翻译:

分子不同的网格蛋白包被的凹坑对 EGFR 命运和信号传导的影响不同。
衔接蛋白 2 (AP2) 是网格蛋白包被的凹坑 (CCP) 的主要成分。它是否对哺乳动物细胞中所有形式的网格蛋白介导的内吞作用 (CME) 都是必需的,这是一个悬而未决的问题。在这里,我们通过实时 TIRF 显微镜证明了在生理、未受干扰的条件下存在缺乏 AP2 的相对短寿命的 CCP 亚类。该亚类保留在 AP2 敲除细胞中,能够支持表皮生长因子受体 (EGFR) 的内化,但不支持转铁蛋白受体 (TfR) 的内化。AP2 非依赖性内吞机制依赖于内吞接头蛋白 eps15、eps15L1 和 epsin1。AP2 的缺失会损害 EGFR 向细胞表面的再循环,从而加剧其降解。因此,在 AP2 消融条件下,我们检测到 EGFR 依赖性 AKT 信号传导和细胞迁移的抑制,认为不同类别的 CCPs 可以在调节 EGFR 循环和信号传导方面提供特殊功能。
更新日期:2019-06-04
中文翻译:

分子不同的网格蛋白包被的凹坑对 EGFR 命运和信号传导的影响不同。
衔接蛋白 2 (AP2) 是网格蛋白包被的凹坑 (CCP) 的主要成分。它是否对哺乳动物细胞中所有形式的网格蛋白介导的内吞作用 (CME) 都是必需的,这是一个悬而未决的问题。在这里,我们通过实时 TIRF 显微镜证明了在生理、未受干扰的条件下存在缺乏 AP2 的相对短寿命的 CCP 亚类。该亚类保留在 AP2 敲除细胞中,能够支持表皮生长因子受体 (EGFR) 的内化,但不支持转铁蛋白受体 (TfR) 的内化。AP2 非依赖性内吞机制依赖于内吞接头蛋白 eps15、eps15L1 和 epsin1。AP2 的缺失会损害 EGFR 向细胞表面的再循环,从而加剧其降解。因此,在 AP2 消融条件下,我们检测到 EGFR 依赖性 AKT 信号传导和细胞迁移的抑制,认为不同类别的 CCPs 可以在调节 EGFR 循环和信号传导方面提供特殊功能。































 京公网安备 11010802027423号
京公网安备 11010802027423号