当前位置:
X-MOL 学术
›
Bioconjugate Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
mRNA Guided Intracellular Self-Assembly of DNA-Gold Nanoparticle Conjugates as a Precise Trigger to Up-Regulate Cell Apoptosis and Activate Photothermal Therapy.
Bioconjugate Chemistry ( IF 4.0 ) Pub Date : 2019-06-10 , DOI: 10.1021/acs.bioconjchem.9b00293 Wanying Ye 1 , Huan Li 1 , Xu Li 1 , Xiaoli Fan 1 , Qiao Jin 1 , Jian Ji 1
Bioconjugate Chemistry ( IF 4.0 ) Pub Date : 2019-06-10 , DOI: 10.1021/acs.bioconjchem.9b00293 Wanying Ye 1 , Huan Li 1 , Xu Li 1 , Xiaoli Fan 1 , Qiao Jin 1 , Jian Ji 1
Affiliation
|
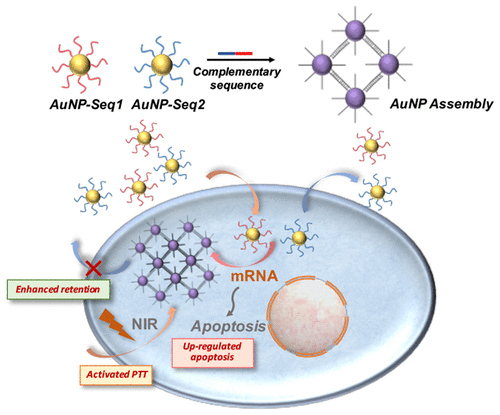
The size of nanoparticles was generally accepted to have a close relationship with the penetration and retention properties among tumor sites, which is one of the most significant issues during nanomedicine delivery. Despite the outstanding stealth property when circulating and the penetration ability in tumor tissue, small nanoparticles still have the problem of inadequate retention time. Taking advantage of the precise self-assembly of DNA-nanoparticle conjugates, we developed an intracellular assembly system to realize the change of nanoparticle size from small to large as well as activation of therapeutic function inside cancer cells. A duplex sequence of cancer-cell-specific mRNA, survivin, was selected to hybridize with complementary sequence of gold nanoparticle-DNA (AuNP-DNA) conjugates in cancer cell cytoplasm, resulting in the specific and precise formation of intracellular assemblies. Enhanced retention behavior of AuNPs inside cancer cells was shown to be achieved because of the increased nanoparticle size. Meanwhile, an up-regulation effect of cell apoptosis and an activated photothermal therapy function were also created by the formation of AuNP aggregations, and eventually contributed to a high rate of cancer cells death up to 93.33%. In contrast, it exhibited almost no toxicity toward normal cells because of the absence of survivin-induced assembly. Therefore, this mRNA guided intracellular assembly system exhibited its potential as a new precise cancer therapy strategy, and also broadened the application field of DNA-conjugated nanoparticle assembly.
中文翻译:

mRNA指导的DNA-金纳米粒子的细胞内自组装共轭,作为精确触发上调细胞凋亡并激活光热疗法。
纳米粒子的大小被普遍认为与肿瘤部位之间的渗透和保留特性密切相关,这是纳米药物输送过程中最重要的问题之一。尽管在循环时具有出色的隐身性能以及在肿瘤组织中的穿透能力,但是小的纳米颗粒仍然存在保留时间不足的问题。利用DNA-纳米颗粒共轭物的精确自组装优势,我们开发了一种细胞内组装系统,以实现纳米颗粒尺寸从小到大的变化以及癌细胞内部治疗功能的激活。选择了癌细胞特异的mRNA,即survivin的双链体序列与癌细胞胞质中的金纳米颗粒-DNA(AuNP-DNA)缀合物的互补序列杂交,导致细胞内装配体的特定和精确的形成。由于增加的纳米颗粒尺寸,显示实现了增强的AuNP在癌细胞内的保留行为。同时,通过形成AuNP聚集体还产生细胞凋亡的上调作用和激活的光热治疗功能,并最终导致高达93.33%的癌细胞死亡。相反,由于不存在存活蛋白诱导的装配,因此它对正常细胞几乎没有毒性。因此,该mRNA指导的细胞内组装系统展现了其作为新的精确癌症治疗策略的潜力,并且拓宽了DNA缀合的纳米颗粒组装的应用领域。由于增加的纳米颗粒尺寸,显示实现了增强的AuNP在癌细胞内的保留行为。同时,通过形成AuNP聚集体还产生细胞凋亡的上调作用和激活的光热治疗功能,并最终导致高达93.33%的癌细胞死亡。相反,由于不存在存活蛋白诱导的装配,因此它对正常细胞几乎没有毒性。因此,该mRNA指导的细胞内组装系统展现了其作为新的精确癌症治疗策略的潜力,并且拓宽了DNA缀合的纳米颗粒组装的应用领域。由于增加的纳米颗粒尺寸,显示实现了增强的AuNP在癌细胞内的保留行为。同时,通过AuNP聚集的形成还产生细胞凋亡的上调作用和激活的光热治疗功能,并最终导致高达93.33%的癌细胞死亡率。相反,由于不存在存活蛋白诱导的装配,因此它对正常细胞几乎没有毒性。因此,该mRNA指导的细胞内组装系统展现了其作为新的精确癌症治疗策略的潜力,并且拓宽了DNA缀合的纳米颗粒组装的应用领域。AuNP聚集的形成还产生了细胞凋亡的上调作用和激活的光疗功能,并最终导致高达93.33%的癌细胞死亡。相反,由于不存在存活蛋白诱导的装配,因此它对正常细胞几乎没有毒性。因此,该mRNA指导的细胞内组装系统展现了其作为新的精确癌症治疗策略的潜力,并且拓宽了DNA缀合的纳米颗粒组装的应用领域。AuNP聚集的形成还产生了细胞凋亡的上调作用和激活的光疗功能,并最终导致高达93.33%的癌细胞死亡。相反,由于不存在存活蛋白诱导的装配,因此它对正常细胞几乎没有毒性。因此,该mRNA指导的细胞内组装系统展现了其作为新的精确癌症治疗策略的潜力,并且拓宽了DNA缀合的纳米颗粒组装的应用领域。
更新日期:2019-05-28
中文翻译:

mRNA指导的DNA-金纳米粒子的细胞内自组装共轭,作为精确触发上调细胞凋亡并激活光热疗法。
纳米粒子的大小被普遍认为与肿瘤部位之间的渗透和保留特性密切相关,这是纳米药物输送过程中最重要的问题之一。尽管在循环时具有出色的隐身性能以及在肿瘤组织中的穿透能力,但是小的纳米颗粒仍然存在保留时间不足的问题。利用DNA-纳米颗粒共轭物的精确自组装优势,我们开发了一种细胞内组装系统,以实现纳米颗粒尺寸从小到大的变化以及癌细胞内部治疗功能的激活。选择了癌细胞特异的mRNA,即survivin的双链体序列与癌细胞胞质中的金纳米颗粒-DNA(AuNP-DNA)缀合物的互补序列杂交,导致细胞内装配体的特定和精确的形成。由于增加的纳米颗粒尺寸,显示实现了增强的AuNP在癌细胞内的保留行为。同时,通过形成AuNP聚集体还产生细胞凋亡的上调作用和激活的光热治疗功能,并最终导致高达93.33%的癌细胞死亡。相反,由于不存在存活蛋白诱导的装配,因此它对正常细胞几乎没有毒性。因此,该mRNA指导的细胞内组装系统展现了其作为新的精确癌症治疗策略的潜力,并且拓宽了DNA缀合的纳米颗粒组装的应用领域。由于增加的纳米颗粒尺寸,显示实现了增强的AuNP在癌细胞内的保留行为。同时,通过形成AuNP聚集体还产生细胞凋亡的上调作用和激活的光热治疗功能,并最终导致高达93.33%的癌细胞死亡。相反,由于不存在存活蛋白诱导的装配,因此它对正常细胞几乎没有毒性。因此,该mRNA指导的细胞内组装系统展现了其作为新的精确癌症治疗策略的潜力,并且拓宽了DNA缀合的纳米颗粒组装的应用领域。由于增加的纳米颗粒尺寸,显示实现了增强的AuNP在癌细胞内的保留行为。同时,通过AuNP聚集的形成还产生细胞凋亡的上调作用和激活的光热治疗功能,并最终导致高达93.33%的癌细胞死亡率。相反,由于不存在存活蛋白诱导的装配,因此它对正常细胞几乎没有毒性。因此,该mRNA指导的细胞内组装系统展现了其作为新的精确癌症治疗策略的潜力,并且拓宽了DNA缀合的纳米颗粒组装的应用领域。AuNP聚集的形成还产生了细胞凋亡的上调作用和激活的光疗功能,并最终导致高达93.33%的癌细胞死亡。相反,由于不存在存活蛋白诱导的装配,因此它对正常细胞几乎没有毒性。因此,该mRNA指导的细胞内组装系统展现了其作为新的精确癌症治疗策略的潜力,并且拓宽了DNA缀合的纳米颗粒组装的应用领域。AuNP聚集的形成还产生了细胞凋亡的上调作用和激活的光疗功能,并最终导致高达93.33%的癌细胞死亡。相反,由于不存在存活蛋白诱导的装配,因此它对正常细胞几乎没有毒性。因此,该mRNA指导的细胞内组装系统展现了其作为新的精确癌症治疗策略的潜力,并且拓宽了DNA缀合的纳米颗粒组装的应用领域。































 京公网安备 11010802027423号
京公网安备 11010802027423号