当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
折叠无关的界面残基对于I类谷氨酰胺酰胺转移酶中的复合物形成和变构信号至关重要。
Biochemistry ( IF 2.9 ) Pub Date : 2019-05-23 , DOI: 10.1021/acs.biochem.9b00286 Florian Semmelmann 1 , Enrico Hupfeld 1 , Leonhard Heizinger 1 , Rainer Merkl 1 , Reinhard Sterner 1
Biochemistry ( IF 2.9 ) Pub Date : 2019-05-23 , DOI: 10.1021/acs.biochem.9b00286 Florian Semmelmann 1 , Enrico Hupfeld 1 , Leonhard Heizinger 1 , Rainer Merkl 1 , Reinhard Sterner 1
Affiliation
|
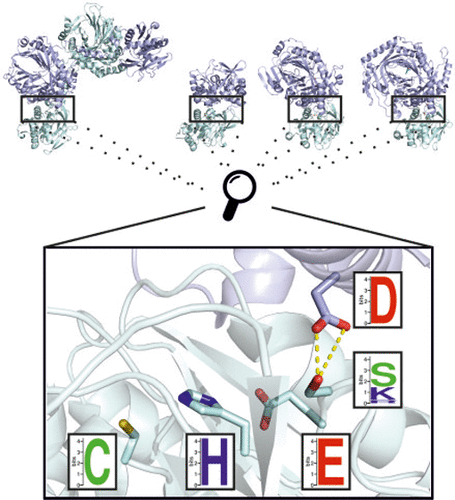
谷氨酰胺酰胺转移酶(GATase)家族的成员催化氨在许多代谢途径中的掺入,可以分为两类。在这里,我们集中于I类GATases,它们是由合成酶亚基和谷氨酰胺酶亚基与催化的Cys-His-Glu三联体组成的异聚酶复合物。谷氨酰胺酶亚基的谷氨酰胺水解取决于(i)依赖于紧密合酶-谷氨酰胺酶复合物的形成,和(ii)与合酶亚基的底物存在变构偶联。复杂的形成和变构的结构基础了解甚少。但是,先前关于4-氨基-4-脱氧胆酸合酶和咪唑甘油磷酸合酶的研究表明,它们的合酶亚基中存在保守的天冬氨酸残基,它位于靠近谷氨酰胺酶催化三联体的亚基界面处,对这两个功能都可能很重要。我们从蛋白质数据库中进行了I类GATases的计算筛选,并确定了保守且位置相似的天冬氨酸残基。然后,我们生成了这些残基的丙氨酸和谷氨酸突变体,并通过分析性凝胶过滤和稳态酶动力学对其进行了表征。结果证实了野生型天冬氨酸残基对于形成稳定的合酶-谷氨酰胺酶复合物(四分之三)和刺激谷氨酰胺酶活性(在所有四例中)具有重要作用。我们提出了一个模型,用于使保守的天冬氨酸残基对整个I类GATase家族的统一调节机制具有双重作用。

"点击查看英文标题和摘要"
更新日期:2019-05-22

"点击查看英文标题和摘要"


















































 京公网安备 11010802027423号
京公网安备 11010802027423号