当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Structure of the human frataxin-bound iron-sulfur cluster assembly complex provides insight into its activation mechanism.
Nature Communications ( IF 14.7 ) Pub Date : 2019-05-17 , DOI: 10.1038/s41467-019-09989-y Nicholas G Fox 1, 2 , Xiaodi Yu 3, 4 , Xidong Feng 3 , Henry J Bailey 1 , Alain Martelli 5 , Joseph F Nabhan 5 , Claire Strain-Damerell 1 , Christine Bulawa 5 , Wyatt W Yue 1 , Seungil Han 3
Nature Communications ( IF 14.7 ) Pub Date : 2019-05-17 , DOI: 10.1038/s41467-019-09989-y Nicholas G Fox 1, 2 , Xiaodi Yu 3, 4 , Xidong Feng 3 , Henry J Bailey 1 , Alain Martelli 5 , Joseph F Nabhan 5 , Claire Strain-Damerell 1 , Christine Bulawa 5 , Wyatt W Yue 1 , Seungil Han 3
Affiliation
|
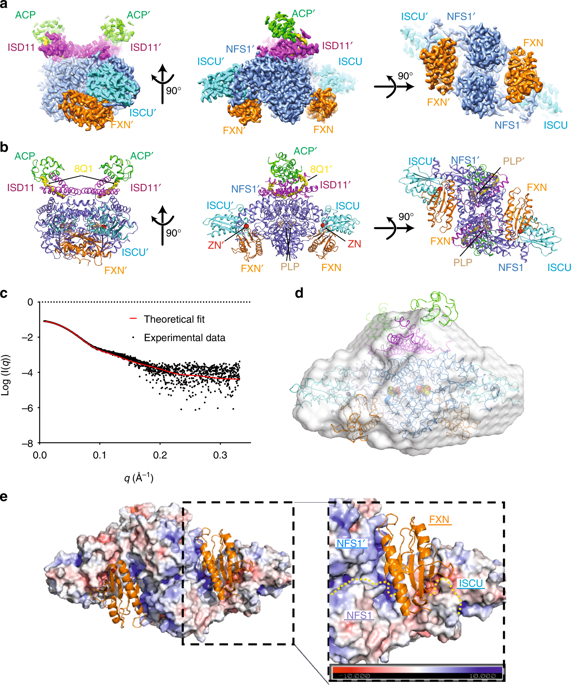
The core machinery for de novo biosynthesis of iron-sulfur clusters (ISC), located in the mitochondria matrix, is a five-protein complex containing the cysteine desulfurase NFS1 that is activated by frataxin (FXN), scaffold protein ISCU, accessory protein ISD11, and acyl-carrier protein ACP. Deficiency in FXN leads to the loss-of-function neurodegenerative disorder Friedreich's ataxia (FRDA). Here the 3.2 Å resolution cryo-electron microscopy structure of the FXN-bound active human complex, containing two copies of the NFS1-ISD11-ACP-ISCU-FXN hetero-pentamer, delineates the interactions of FXN with other component proteins of the complex. FXN binds at the interface of two NFS1 and one ISCU subunits, modifying the local environment of a bound zinc ion that would otherwise inhibit NFS1 activity in complexes without FXN. Our structure reveals how FXN facilitates ISC production through stabilizing key loop conformations of NFS1 and ISCU at the protein-protein interfaces, and suggests how FRDA clinical mutations affect complex formation and FXN activation.
中文翻译:

人类 frataxin 结合的铁硫簇组装复合物的结构提供了对其激活机制的深入了解。
铁硫簇 (ISC) 从头生物合成的核心机制位于线粒体基质中,是一种五蛋白复合物,包含由 frataxin (FXN) 激活的半胱氨酸脱硫酶 NFS1、支架蛋白 ISCU、辅助蛋白 ISD11、和酰基载体蛋白ACP。 FXN 缺乏会导致功能丧失性神经退行性疾病弗里德赖希共济失调 (FRDA)。这里,FXN 结合的活性人类复合物的 3.2 Å 分辨率冷冻电子显微镜结构包含 NFS1-ISD11-ACP-ISCU-FXN 异五聚体的两个副本,描绘了 FXN 与该复合物的其他组成蛋白的相互作用。 FXN 结合在两个 NFS1 和一个 ISCU 亚基的界面上,改变结合锌离子的局部环境,否则在没有 FXN 的复合物中,锌离子会抑制 NFS1 活性。我们的结构揭示了 FXN 如何通过稳定蛋白质-蛋白质界面处 NFS1 和 ISCU 的关键环构象来促进 ISC 产生,并表明 FRDA 临床突变如何影响复合物形成和 FXN 激活。
更新日期:2019-05-17
中文翻译:

人类 frataxin 结合的铁硫簇组装复合物的结构提供了对其激活机制的深入了解。
铁硫簇 (ISC) 从头生物合成的核心机制位于线粒体基质中,是一种五蛋白复合物,包含由 frataxin (FXN) 激活的半胱氨酸脱硫酶 NFS1、支架蛋白 ISCU、辅助蛋白 ISD11、和酰基载体蛋白ACP。 FXN 缺乏会导致功能丧失性神经退行性疾病弗里德赖希共济失调 (FRDA)。这里,FXN 结合的活性人类复合物的 3.2 Å 分辨率冷冻电子显微镜结构包含 NFS1-ISD11-ACP-ISCU-FXN 异五聚体的两个副本,描绘了 FXN 与该复合物的其他组成蛋白的相互作用。 FXN 结合在两个 NFS1 和一个 ISCU 亚基的界面上,改变结合锌离子的局部环境,否则在没有 FXN 的复合物中,锌离子会抑制 NFS1 活性。我们的结构揭示了 FXN 如何通过稳定蛋白质-蛋白质界面处 NFS1 和 ISCU 的关键环构象来促进 ISC 产生,并表明 FRDA 临床突变如何影响复合物形成和 FXN 激活。





















































 京公网安备 11010802027423号
京公网安备 11010802027423号