当前位置:
X-MOL 学术
›
J. Phys. Chem. A
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Exploring Amyloid-β Dimer Structure Using Molecular Dynamics Simulations
The Journal of Physical Chemistry A ( IF 2.7 ) Pub Date : 2019-05-13 00:00:00 , DOI: 10.1021/acs.jpca.8b11251
Banafsheh Mehrazma 1 , Arvi Rauk 1
The Journal of Physical Chemistry A ( IF 2.7 ) Pub Date : 2019-05-13 00:00:00 , DOI: 10.1021/acs.jpca.8b11251
Banafsheh Mehrazma 1 , Arvi Rauk 1
Affiliation
|
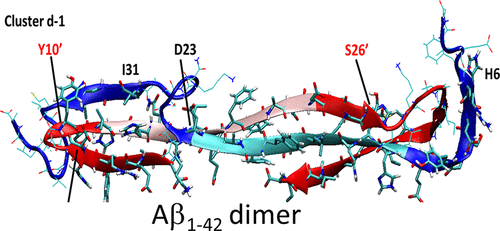
A major hallmark of Alzheimer’s disease (AD) is the aggregation of amyloid-β peptides in the brains of people afflicted by the disease. The exact pathway to this catastrophic event is unknown. In this work, a total of 9.5 μs molecular dynamics simulations have been performed to investigate the structure and dynamics of the smallest form of toxic Aβ oligomers, i.e., the Aβ dimers. This study suggests that specific hydrophobic regions are vital in the aggregation process. Different possible structures for Aβ dimers are reported along with their relative binding affinity. These data may be used to design better Aβ-aggregation inhibitors. The diversity of the dimer structures suggests several aggregation pathways.
中文翻译:

使用分子动力学模拟探索淀粉样β-二聚体结构
阿尔茨海默氏病(AD)的一个主要标志是淀粉样β肽在受该病困扰的人们的大脑中的聚集。导致这一灾难性事件的确切途径尚不清楚。在这项工作中,总共进行了9.5μs的分子动力学模拟,以研究最小形式的有毒Aβ低聚物即Aβ二聚体的结构和动力学。这项研究表明特定的疏水区域在聚集过程中至关重要。报道了Aβ二聚体的不同可能结构及其相对结合亲和力。这些数据可以用于设计更好的Aβ-聚集抑制剂。二聚体结构的多样性提示了几种聚集途径。
更新日期:2019-05-13
中文翻译:

使用分子动力学模拟探索淀粉样β-二聚体结构
阿尔茨海默氏病(AD)的一个主要标志是淀粉样β肽在受该病困扰的人们的大脑中的聚集。导致这一灾难性事件的确切途径尚不清楚。在这项工作中,总共进行了9.5μs的分子动力学模拟,以研究最小形式的有毒Aβ低聚物即Aβ二聚体的结构和动力学。这项研究表明特定的疏水区域在聚集过程中至关重要。报道了Aβ二聚体的不同可能结构及其相对结合亲和力。这些数据可以用于设计更好的Aβ-聚集抑制剂。二聚体结构的多样性提示了几种聚集途径。

































 京公网安备 11010802027423号
京公网安备 11010802027423号