当前位置:
X-MOL 学术
›
Signal Transduct. Target Ther.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Structural basis for the acetylation of histone H3K9 and H3K27 mediated by the histone chaperone Vps75 in Pneumocystis carinii.
Signal Transduction and Targeted Therapy ( IF 40.8 ) Pub Date : 2019-05-10 , DOI: 10.1038/s41392-019-0047-8
Yiping Chen 1 , Yang Zhang 1 , Hui Ye 2 , Yanshu Dou 1 , Deren Lu 1 , Xiaolu Li 3 , Andrew H Limper 4 , Junhong Han 1 , Dan Su 1
Signal Transduction and Targeted Therapy ( IF 40.8 ) Pub Date : 2019-05-10 , DOI: 10.1038/s41392-019-0047-8
Yiping Chen 1 , Yang Zhang 1 , Hui Ye 2 , Yanshu Dou 1 , Deren Lu 1 , Xiaolu Li 3 , Andrew H Limper 4 , Junhong Han 1 , Dan Su 1
Affiliation
|
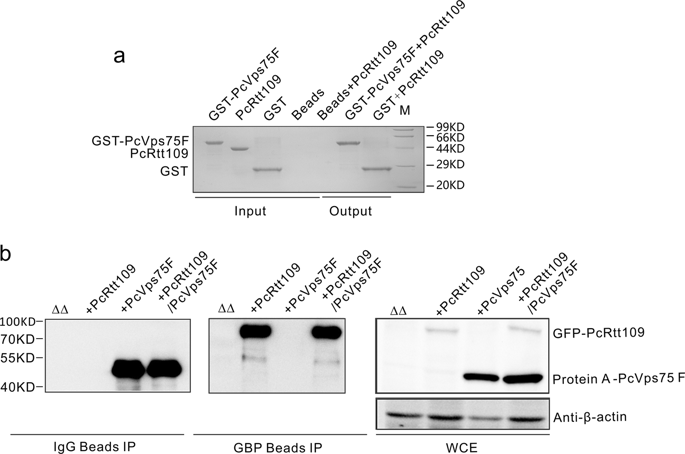
Rtt109 is a histone acetyltransferase (HAT) that is a potential therapeutic target in conditioned pathogenic fungi Pneumocystis carinii (P. carinii). The histone chaperone Vps75 can stimulate the Rtt109-dependent acetylation of several histone H3 lysines and preferentially acetylates H3K9 and H3K27 within canonical histone (H3-H4)2 tetramers. Vps75 shows two protein conformations assembled into dimeric and tetrameric forms, but the roles played by multimeric forms of Vps75 in Rtt109-mediated histone acetylation remain elusive. In P. carinii, we identified that Vps75 (PcVps75) dimers regulate H3K9 and H3K27 acetylation by directly interacting with histone (H3-H4)2 tetramers, rather than by forming a Vps75-Rtt109 complex. For PcVps75 tetramers, the major histone-binding surface is buried within a walnut-like structure in the absence of a histone cargo. Based on crystal structures of dimeric and tetrameric forms of PcVps75, as well as HAT assay data, we confirmed that residues 192E, 193D, 194E, 195E, and 196E and the disordered C-terminal tail (residues 224-250) of PcVps75 mediate interactions with histones and are important for the Rtt109 in P. carinii (PcRtt109)-mediated acetylation of H3K9 and H3K27, both in vitro and in yeast cells. Furthermore, expressing PcRtt109 alone or in combination with PcVps75 variants that cannot effectively bind histones could not fully restore cellular growth in the presence of genotoxic agents that block DNA replication owing to the absence of H3K9 and H3K27 acetylation. Together, these data indicate that the interaction between PcVps75 and histone (H3-H4)2 tetramers is a critical regulator of the Rtt109-mediated acetylation of H3K9 and H3K27.
中文翻译:

卡氏肺囊虫中组蛋白伴侣 Vps75 介导的组蛋白 H3K9 和 H3K27 乙酰化的结构基础。
Rtt109 是一种组蛋白乙酰转移酶 (HAT),是条件致病性真菌卡氏肺囊虫 (P. carinii) 的潜在治疗靶点。组蛋白伴侣 Vps75 可以刺激多个组蛋白 H3 赖氨酸的 Rtt109 依赖性乙酰化,并优先乙酰化典型组蛋白 (H3-H4)2 四聚体中的 H3K9 和 H3K27。Vps75 显示两种蛋白质构象组装成二聚体和四聚体形式,但多聚体形式的 Vps75 在 Rtt109 介导的组蛋白乙酰化中所起的作用仍然难以捉摸。在 P. carinii 中,我们发现 Vps75 (PcVps75) 二聚体通过直接与组蛋白 (H3-H4)2 四聚体相互作用来调节 H3K9 和 H3K27 乙酰化,而不是通过形成 Vps75-Rtt109 复合物。对于 PcVps75 四聚体,在没有组蛋白货物的情况下,主要的组蛋白结合表面被埋在核桃样结构内。基于 PcVps75 二聚体和四聚体形式的晶体结构以及 HAT 测定数据,我们证实 PcVps75 的残基 192E、193D、194E、195E 和 196E 以及无序的 C 末端尾部(残基 224-250)介导相互作用与组蛋白结合,对于体外和酵母细胞中 P. carinii (PcRtt109) 介导的 H3K9 和 H3K27 的 Rtt109 乙酰化非常重要。此外,单独表达 PcRtt109 或与不能有效结合组蛋白的 PcVps75 变体组合表达,在由于缺乏 H3K9 和 H3K27 乙酰化而阻断 DNA 复制的基因毒性剂存在下,无法完全恢复细胞生长。总之,这些数据表明 PcVps75 和组蛋白 (H3-H4)2 四聚体之间的相互作用是 Rtt109 介导的 H3K9 和 H3K27 乙酰化的关键调节因子。
更新日期:2019-11-18
中文翻译:

卡氏肺囊虫中组蛋白伴侣 Vps75 介导的组蛋白 H3K9 和 H3K27 乙酰化的结构基础。
Rtt109 是一种组蛋白乙酰转移酶 (HAT),是条件致病性真菌卡氏肺囊虫 (P. carinii) 的潜在治疗靶点。组蛋白伴侣 Vps75 可以刺激多个组蛋白 H3 赖氨酸的 Rtt109 依赖性乙酰化,并优先乙酰化典型组蛋白 (H3-H4)2 四聚体中的 H3K9 和 H3K27。Vps75 显示两种蛋白质构象组装成二聚体和四聚体形式,但多聚体形式的 Vps75 在 Rtt109 介导的组蛋白乙酰化中所起的作用仍然难以捉摸。在 P. carinii 中,我们发现 Vps75 (PcVps75) 二聚体通过直接与组蛋白 (H3-H4)2 四聚体相互作用来调节 H3K9 和 H3K27 乙酰化,而不是通过形成 Vps75-Rtt109 复合物。对于 PcVps75 四聚体,在没有组蛋白货物的情况下,主要的组蛋白结合表面被埋在核桃样结构内。基于 PcVps75 二聚体和四聚体形式的晶体结构以及 HAT 测定数据,我们证实 PcVps75 的残基 192E、193D、194E、195E 和 196E 以及无序的 C 末端尾部(残基 224-250)介导相互作用与组蛋白结合,对于体外和酵母细胞中 P. carinii (PcRtt109) 介导的 H3K9 和 H3K27 的 Rtt109 乙酰化非常重要。此外,单独表达 PcRtt109 或与不能有效结合组蛋白的 PcVps75 变体组合表达,在由于缺乏 H3K9 和 H3K27 乙酰化而阻断 DNA 复制的基因毒性剂存在下,无法完全恢复细胞生长。总之,这些数据表明 PcVps75 和组蛋白 (H3-H4)2 四聚体之间的相互作用是 Rtt109 介导的 H3K9 和 H3K27 乙酰化的关键调节因子。

































 京公网安备 11010802027423号
京公网安备 11010802027423号