当前位置:
X-MOL 学术
›
Cell. Mol. Immunol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
ZBP1 mediates interferon-induced necroptosis.
Cellular & Molecular Immunology ( IF 21.8 ) Pub Date : 2019-05-10 , DOI: 10.1038/s41423-019-0237-x
Daowei Yang 1 , Yaoji Liang 1, 2, 3, 4 , Shubo Zhao 1 , Yan Ding 1 , Qiuyu Zhuang 1 , Qilin Shi 1 , Tingting Ai 1 , Su-Qin Wu 1 , Jiahuai Han 1
Cellular & Molecular Immunology ( IF 21.8 ) Pub Date : 2019-05-10 , DOI: 10.1038/s41423-019-0237-x
Daowei Yang 1 , Yaoji Liang 1, 2, 3, 4 , Shubo Zhao 1 , Yan Ding 1 , Qiuyu Zhuang 1 , Qilin Shi 1 , Tingting Ai 1 , Su-Qin Wu 1 , Jiahuai Han 1
Affiliation
|
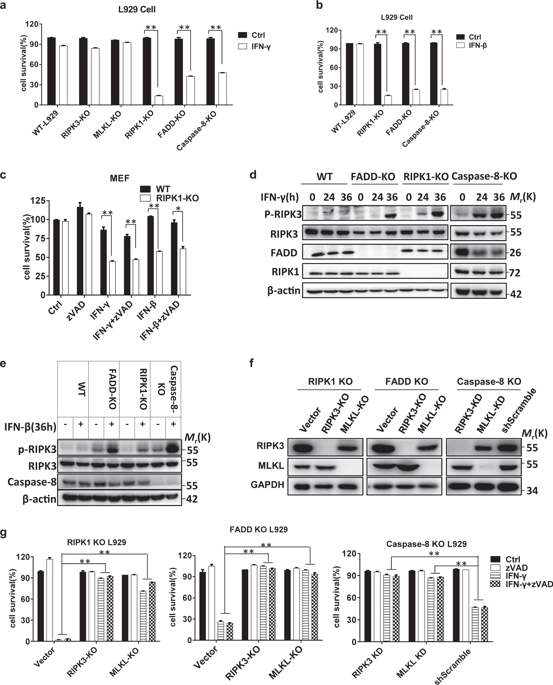
Interferons (IFNs) play an important role in immunomodulatory and antiviral functions. IFN-induced necroptosis has been reported in cells deficient in receptor-interacting protein kinase 1 (RIPK1), Fas-associated protein with death domain (FADD), or caspase-8, but the mechanism is largely unknown. Here, we report that the DNA-dependent activator of IFN regulatory factors (ZBP1, also known as DAI) is required for both type I (β) and type II (γ) IFN-induced necroptosis. We show that L929 fibroblast cells became susceptible to IFN-induced necroptosis when RIPK1, FADD, or Caspase-8 was genetically deleted, confirming the antinecroptotic role of these proteins in IFN signaling. We found that the pronecroptotic signal from IFN stimulation depends on new protein synthesis and identified ZBP1, an IFN-stimulated gene (ISG) product, as the de novo synthesized protein that triggers necroptosis in IFN-stimulated cells. The N-terminal domain (ND) of ZBP1 is important for ZBP1-ZBP1 homointeraction, and its RHIM domain in the C-terminal region interacts with RIPK3 to initiate RIPK3-dependent necroptosis. The antinecroptotic function of RIPK1, FADD, and caspase-8 in IFN-treated cells is most likely executed by caspase-8-mediated cleavage of RIPK3, since the inhibitory effect on necroptosis was eliminated when the caspase-8 cleavage site in RIPK3 was mutated. ZBP1-mediated necroptosis in IFN-treated cells is likely physiologically relevant, as ZBP1 KO mice were significantly protected against acute systemic inflammatory response syndrome (SIRS) induced by TNF + IFN-γ.
中文翻译:

ZBP1 介导干扰素诱导的坏死性凋亡。
干扰素 (IFN) 在免疫调节和抗病毒功能中发挥重要作用。据报道,在受体相互作用蛋白激酶 1 (RIPK1)、具有死亡结构域的 Fas 相关蛋白 (FADD) 或 caspase-8 缺陷的细胞中,IFN 诱导的坏死性凋亡,但其机制在很大程度上是未知的。在这里,我们报告了 I 型 (β) 和 II 型 (γ) IFN 诱导的坏死性凋亡都需要 IFN 调节因子的 DNA 依赖性激活剂(ZBP1,也称为 DAI)。我们表明,当 RIPK1、FADD 或 Caspase-8 基因缺失时,L929 成纤维细胞变得容易受到 IFN 诱导的坏死性凋亡,这证实了这些蛋白质在 IFN 信号传导中的抗坏死作用。我们发现来自 IFN 刺激的 procroptotic 信号取决于新的蛋白质合成,并确定了 ZBP1,一种 IFN 刺激的基因 (ISG) 产物,作为在 IFN 刺激的细胞中触发坏死性凋亡的从头合成的蛋白质。ZBP1 的 N 端结构域 (ND) 对 ZBP1-ZBP1 同源相互作用很重要,其 C 端区域的 RHIM 结构域与 RIPK3 相互作用以启动 RIPK3 依赖性坏死性凋亡。RIPK1、FADD 和 caspase-8 在 IFN 处理的细胞中的抗坏死功能很可能是通过 caspase-8 介导的 RIPK3 切割来执行的,因为当 RIPK3 中的 caspase-8 切割位点发生突变时,对坏死性凋亡的抑制作用被消除. ZBP1 介导的 IFN 处理细胞中的坏死性凋亡可能具有生理相关性,因为 ZBP1 KO 小鼠受到 TNF + IFN-γ 诱导的急性全身炎症反应综合征 (SIRS) 的显着保护。ZBP1 的 N 端结构域 (ND) 对 ZBP1-ZBP1 同源相互作用很重要,其 C 端区域的 RHIM 结构域与 RIPK3 相互作用以启动 RIPK3 依赖性坏死性凋亡。RIPK1、FADD 和 caspase-8 在 IFN 处理的细胞中的抗坏死功能很可能是通过 caspase-8 介导的 RIPK3 切割来执行的,因为当 RIPK3 中的 caspase-8 切割位点发生突变时,对坏死性凋亡的抑制作用被消除. ZBP1 介导的 IFN 处理细胞中的坏死性凋亡可能具有生理相关性,因为 ZBP1 KO 小鼠受到 TNF + IFN-γ 诱导的急性全身炎症反应综合征 (SIRS) 的显着保护。ZBP1 的 N 端结构域 (ND) 对 ZBP1-ZBP1 同源相互作用很重要,其 C 端区域的 RHIM 结构域与 RIPK3 相互作用以启动 RIPK3 依赖性坏死性凋亡。RIPK1、FADD 和 caspase-8 在 IFN 处理的细胞中的抗坏死功能很可能是通过 caspase-8 介导的 RIPK3 切割来执行的,因为当 RIPK3 中的 caspase-8 切割位点发生突变时,对坏死性凋亡的抑制作用被消除. ZBP1 介导的 IFN 处理细胞中的坏死性凋亡可能具有生理相关性,因为 ZBP1 KO 小鼠受到 TNF + IFN-γ 诱导的急性全身炎症反应综合征 (SIRS) 的显着保护。和 IFN 处理的细胞中的 caspase-8 最有可能通过 caspase-8 介导的 RIPK3 切割来执行,因为当 RIPK3 中的 caspase-8 切割位点发生突变时,对坏死性凋亡的抑制作用被消除。ZBP1 介导的 IFN 处理细胞中的坏死性凋亡可能具有生理相关性,因为 ZBP1 KO 小鼠受到 TNF + IFN-γ 诱导的急性全身炎症反应综合征 (SIRS) 的显着保护。和 IFN 处理的细胞中的 caspase-8 最有可能通过 caspase-8 介导的 RIPK3 切割来执行,因为当 RIPK3 中的 caspase-8 切割位点发生突变时,对坏死性凋亡的抑制作用被消除。ZBP1 介导的 IFN 处理细胞中的坏死性凋亡可能具有生理相关性,因为 ZBP1 KO 小鼠受到 TNF + IFN-γ 诱导的急性全身炎症反应综合征 (SIRS) 的显着保护。
更新日期:2019-05-16
中文翻译:

ZBP1 介导干扰素诱导的坏死性凋亡。
干扰素 (IFN) 在免疫调节和抗病毒功能中发挥重要作用。据报道,在受体相互作用蛋白激酶 1 (RIPK1)、具有死亡结构域的 Fas 相关蛋白 (FADD) 或 caspase-8 缺陷的细胞中,IFN 诱导的坏死性凋亡,但其机制在很大程度上是未知的。在这里,我们报告了 I 型 (β) 和 II 型 (γ) IFN 诱导的坏死性凋亡都需要 IFN 调节因子的 DNA 依赖性激活剂(ZBP1,也称为 DAI)。我们表明,当 RIPK1、FADD 或 Caspase-8 基因缺失时,L929 成纤维细胞变得容易受到 IFN 诱导的坏死性凋亡,这证实了这些蛋白质在 IFN 信号传导中的抗坏死作用。我们发现来自 IFN 刺激的 procroptotic 信号取决于新的蛋白质合成,并确定了 ZBP1,一种 IFN 刺激的基因 (ISG) 产物,作为在 IFN 刺激的细胞中触发坏死性凋亡的从头合成的蛋白质。ZBP1 的 N 端结构域 (ND) 对 ZBP1-ZBP1 同源相互作用很重要,其 C 端区域的 RHIM 结构域与 RIPK3 相互作用以启动 RIPK3 依赖性坏死性凋亡。RIPK1、FADD 和 caspase-8 在 IFN 处理的细胞中的抗坏死功能很可能是通过 caspase-8 介导的 RIPK3 切割来执行的,因为当 RIPK3 中的 caspase-8 切割位点发生突变时,对坏死性凋亡的抑制作用被消除. ZBP1 介导的 IFN 处理细胞中的坏死性凋亡可能具有生理相关性,因为 ZBP1 KO 小鼠受到 TNF + IFN-γ 诱导的急性全身炎症反应综合征 (SIRS) 的显着保护。ZBP1 的 N 端结构域 (ND) 对 ZBP1-ZBP1 同源相互作用很重要,其 C 端区域的 RHIM 结构域与 RIPK3 相互作用以启动 RIPK3 依赖性坏死性凋亡。RIPK1、FADD 和 caspase-8 在 IFN 处理的细胞中的抗坏死功能很可能是通过 caspase-8 介导的 RIPK3 切割来执行的,因为当 RIPK3 中的 caspase-8 切割位点发生突变时,对坏死性凋亡的抑制作用被消除. ZBP1 介导的 IFN 处理细胞中的坏死性凋亡可能具有生理相关性,因为 ZBP1 KO 小鼠受到 TNF + IFN-γ 诱导的急性全身炎症反应综合征 (SIRS) 的显着保护。ZBP1 的 N 端结构域 (ND) 对 ZBP1-ZBP1 同源相互作用很重要,其 C 端区域的 RHIM 结构域与 RIPK3 相互作用以启动 RIPK3 依赖性坏死性凋亡。RIPK1、FADD 和 caspase-8 在 IFN 处理的细胞中的抗坏死功能很可能是通过 caspase-8 介导的 RIPK3 切割来执行的,因为当 RIPK3 中的 caspase-8 切割位点发生突变时,对坏死性凋亡的抑制作用被消除. ZBP1 介导的 IFN 处理细胞中的坏死性凋亡可能具有生理相关性,因为 ZBP1 KO 小鼠受到 TNF + IFN-γ 诱导的急性全身炎症反应综合征 (SIRS) 的显着保护。和 IFN 处理的细胞中的 caspase-8 最有可能通过 caspase-8 介导的 RIPK3 切割来执行,因为当 RIPK3 中的 caspase-8 切割位点发生突变时,对坏死性凋亡的抑制作用被消除。ZBP1 介导的 IFN 处理细胞中的坏死性凋亡可能具有生理相关性,因为 ZBP1 KO 小鼠受到 TNF + IFN-γ 诱导的急性全身炎症反应综合征 (SIRS) 的显着保护。和 IFN 处理的细胞中的 caspase-8 最有可能通过 caspase-8 介导的 RIPK3 切割来执行,因为当 RIPK3 中的 caspase-8 切割位点发生突变时,对坏死性凋亡的抑制作用被消除。ZBP1 介导的 IFN 处理细胞中的坏死性凋亡可能具有生理相关性,因为 ZBP1 KO 小鼠受到 TNF + IFN-γ 诱导的急性全身炎症反应综合征 (SIRS) 的显着保护。


































 京公网安备 11010802027423号
京公网安备 11010802027423号