当前位置:
X-MOL 学术
›
ACS Catal.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
底物结合诱导A类β-内酰胺酶的构象变化,该构象变化会引发催化作用
ACS Catalysis ( IF 11.3 ) Pub Date : 2018-02-15 00:00:00 , DOI: 10.1021/acscatal.7b04114
Patricia S. Langan 1 , Venu Gopal Vandavasi 1 , Sarah J. Cooper 2 , Kevin L. Weiss 1 , Stephan L. Ginell 3 , Jerry M. Parks 2, 4 , Leighton Coates 1
ACS Catalysis ( IF 11.3 ) Pub Date : 2018-02-15 00:00:00 , DOI: 10.1021/acscatal.7b04114
Patricia S. Langan 1 , Venu Gopal Vandavasi 1 , Sarah J. Cooper 2 , Kevin L. Weiss 1 , Stephan L. Ginell 3 , Jerry M. Parks 2, 4 , Leighton Coates 1
Affiliation
|
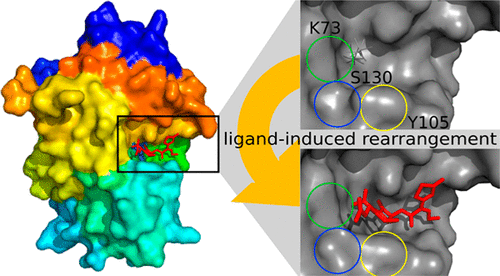
通过β-内酰胺酶产生和传播细菌对β-内酰胺抗生素的耐药性在临床环境中是一个严重的问题,对于由多药耐药的超级细菌引起的感染,通常留下很少的治疗选择。了解β-内酰胺酶的催化机制对于制定克服耐药性的策略很重要。底物在酶活性位点上的结合可以改变构象和p K as个催化残基,从而有助于酶催化。在这里,我们报告载脂蛋白形式的A类Toho-1β-内酰胺酶的X射线和中子晶体结构,以及在活动部位带有头孢菌素头孢噻肟的米氏菌类复合物的X射线结构。这些结构的比较表明,底物结合引起一系列变化。在催化中重要的保守残基Lys73和Tyr105的侧链以及Ser130的主链会改变其构象,Lys73的Nζ移近保守的催化亲核试剂Ser70的位置。Lys73靠近Ser70的这种移动与酰化之前两个残基之间的质子转移相一致。结合位于Glu166和Ser70位置之间的紧密结合的催化水分子,当Ser70被激活以引起β-内酰胺环的亲核攻击时,该酶被引发催化作用。野生型酶模型的量子力学/分子力学(QM / MM)自由能模拟表明,质子从Lys73的Nζ转移到Glu166的Oε2原子比没有质子时更具有热力学优势。综上所述,我们的发现表明底物结合增强了在酰基酶中间体形成之前的初始质子转移步骤的有利性。

"点击查看英文标题和摘要"
更新日期:2018-02-15

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号