Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Cell-penetrating peptide sequence and modification dependent uptake and subcellular distribution of green florescent protein in different cell lines.
Scientific Reports ( IF 3.8 ) Pub Date : 2019-04-18 , DOI: 10.1038/s41598-019-42456-8
Sanjay G Patel 1 , Edward J Sayers 2 , Lin He 2 , Rohan Narayan 2 , Thomas L Williams 1 , Emily M Mills 1 , Rudolf K Allemann 1 , Louis Y P Luk 1 , Arwyn T Jones 2 , Yu-Hsuan Tsai 1
Scientific Reports ( IF 3.8 ) Pub Date : 2019-04-18 , DOI: 10.1038/s41598-019-42456-8
Sanjay G Patel 1 , Edward J Sayers 2 , Lin He 2 , Rohan Narayan 2 , Thomas L Williams 1 , Emily M Mills 1 , Rudolf K Allemann 1 , Louis Y P Luk 1 , Arwyn T Jones 2 , Yu-Hsuan Tsai 1
Affiliation
|
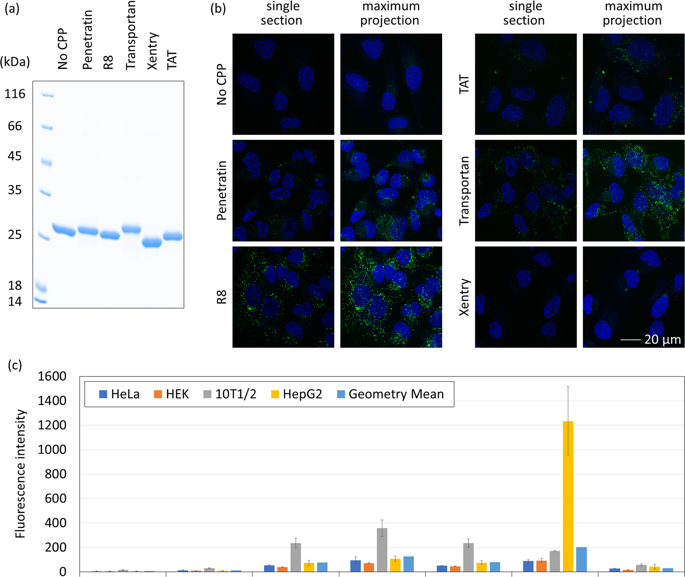
Protein therapy holds great promise for treating a variety of diseases. To act on intracellular targets, therapeutic proteins must cross the plasma membrane. This has previously been achieved by covalent attachment to a variety of cell-penetrating peptides (CPPs). However, there is limited information on the relative performance of CPPs in delivering proteins to cells, specifically the cytosol and other intracellular locations. Here we use green fluorescent protein (GFP) as a model cargo to compare delivery capacity of five CPP sequences (Penetratin, R8, TAT, Transportan, Xentry) and cyclic derivatives in different human cell lines (HeLa, HEK, 10T1/2, HepG2) representing different tissues. Confocal microscopy analysis indicates that most fusion proteins when incubated with cells at 10 µM localise to endosomes. Quantification of cellular uptake by flow cytometry reveals that uptake depends on both cell type (10T1/2 > HepG2 > HeLa > HEK), and CPP sequence (Transportan > R8 > Penetratin≈TAT > Xentry). CPP sequence cyclisation or addition of a HA-sequence increased cellular uptake, but fluorescence was still contained in vesicles with no evidence of endosomal escape. Our results provide a guide to select CPP for endosomal/lysosomal delivery and a basis for developing more efficient CPPs in the future.
中文翻译:

绿色荧光蛋白在不同细胞系中的细胞穿透肽序列和修饰依赖性摄取和亚细胞分布。
蛋白质疗法在治疗多种疾病方面大有希望。为了作用于细胞内靶标,治疗性蛋白质必须穿过质膜。这以前是通过与多种细胞穿透肽 (CPP) 共价连接来实现的。然而,关于 CPP 在向细胞(特别是胞质溶胶和其他细胞内位置)递送蛋白质方面的相对性能的信息有限。在这里,我们使用绿色荧光蛋白 (GFP) 作为模型货物来比较五种 CPP 序列(Penetratin、R8、TAT、Transportan、Xentry)和环状衍生物在不同人类细胞系(HeLa、HEK、10T1/2、HepG2)中的传递能力) 代表不同的组织。共聚焦显微镜分析表明,当与 10 μM 的细胞一起孵育时,大多数融合蛋白会定位到内体。流式细胞仪对细胞摄取的量化表明,摄取取决于细胞类型 (10T1/2 > HepG2 > HeLa > HEK) 和 CPP 序列 (Transportan > R8 > Penetratin≈TAT > Xentry)。CPP 序列环化或添加 HA 序列增加了细胞摄取,但荧光仍包含在囊泡中,没有内体逃逸的证据。我们的结果为选择用于内体/溶酶体递送的 CPP 提供了指导,并为未来开发更有效的 CPPs 奠定了基础。
更新日期:2019-04-20
中文翻译:

绿色荧光蛋白在不同细胞系中的细胞穿透肽序列和修饰依赖性摄取和亚细胞分布。
蛋白质疗法在治疗多种疾病方面大有希望。为了作用于细胞内靶标,治疗性蛋白质必须穿过质膜。这以前是通过与多种细胞穿透肽 (CPP) 共价连接来实现的。然而,关于 CPP 在向细胞(特别是胞质溶胶和其他细胞内位置)递送蛋白质方面的相对性能的信息有限。在这里,我们使用绿色荧光蛋白 (GFP) 作为模型货物来比较五种 CPP 序列(Penetratin、R8、TAT、Transportan、Xentry)和环状衍生物在不同人类细胞系(HeLa、HEK、10T1/2、HepG2)中的传递能力) 代表不同的组织。共聚焦显微镜分析表明,当与 10 μM 的细胞一起孵育时,大多数融合蛋白会定位到内体。流式细胞仪对细胞摄取的量化表明,摄取取决于细胞类型 (10T1/2 > HepG2 > HeLa > HEK) 和 CPP 序列 (Transportan > R8 > Penetratin≈TAT > Xentry)。CPP 序列环化或添加 HA 序列增加了细胞摄取,但荧光仍包含在囊泡中,没有内体逃逸的证据。我们的结果为选择用于内体/溶酶体递送的 CPP 提供了指导,并为未来开发更有效的 CPPs 奠定了基础。































 京公网安备 11010802027423号
京公网安备 11010802027423号