当前位置:
X-MOL 学术
›
J. Mol. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
CDK1中催化赖氨酸的电荷状态对Cyclin-B结合的变构调节对于细胞周期进程至关重要。
Journal of Molecular Biology ( IF 4.7 ) Pub Date : 2019-04-09 , DOI: 10.1016/j.jmb.2019.04.005 Shaunak Deota , Sivasudhan Rathnachalam , Kanojia Namrata , Mayank Boob , Amit Fulzele , S. Radhika , Shubhra Ganguli , Chinthapalli Balaji , Stephanie Kaypee , Krishna Kant Vishwakarma , Tapas Kumar Kundu , Rashna Bhandari , Anne Gonzalez de Peredo , Mithilesh Mishra , Ravindra Venkatramani , Ullas Kolthur-Seetharam

"点击查看英文标题和摘要"
更新日期:2019-04-09
Journal of Molecular Biology ( IF 4.7 ) Pub Date : 2019-04-09 , DOI: 10.1016/j.jmb.2019.04.005 Shaunak Deota , Sivasudhan Rathnachalam , Kanojia Namrata , Mayank Boob , Amit Fulzele , S. Radhika , Shubhra Ganguli , Chinthapalli Balaji , Stephanie Kaypee , Krishna Kant Vishwakarma , Tapas Kumar Kundu , Rashna Bhandari , Anne Gonzalez de Peredo , Mithilesh Mishra , Ravindra Venkatramani , Ullas Kolthur-Seetharam
|
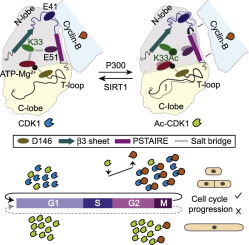
细胞周期蛋白依赖性激酶1(CDK1)对于细胞周期进程至关重要。尽管已经很好地确定了CDK活性对细胞周期蛋白水平的依赖性,但调节其结合的分子机制却鲜为人知。在这里,我们首次报告CDK1:cyclin-B结合不是默认的,而是由CDK1中进化上保守的催化残基赖氨酸33决定的。我们证明此赖氨酸的电荷状态变构地重塑CDK1:cyclin-B接口。赖氨酸33的细胞周期依赖性乙酰化或其模仿乙酰化的谷氨酰胺突变消除了细胞周期蛋白B的结合。使用生化方法和原子分子动力学模拟,我们发现扰动催化赖氨酸的带电状态的近距离和远距离影响,这会抑制激酶活性。具体而言,尽管催化赖氨酸电荷状态的丧失并没有显着影响ATP结合,但它改变了其在活性位点的方向。另外,催化赖氨酸还在活性位点处充当分子内静电束缚,以定向与细胞周期蛋白B连接的结构元件。在生理上,SIRT1和P300的相反活性调节乙酰化,从而控制赖氨酸33的电荷状态。重要的是,在酵母中表达Cdc2 / CDK1的乙酰化模拟突变体的细胞被阻滞在G2中并且无法分裂,这表明细胞分裂需要赖氨酸的乙酰化状态。因此,通过说明催化赖氨酸和细胞周期依赖性脱乙酰基作用作为CDK1:cyclin-B相互作用决定因素的分子作用,

"点击查看英文标题和摘要"






























 京公网安备 11010802027423号
京公网安备 11010802027423号