当前位置:
X-MOL 学术
›
Lancet Oncol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Lenvatinib 联合 pembrolizumab 治疗晚期子宫内膜癌患者:一项多中心、开放标签、单臂、2 期试验的中期分析。
The Lancet Oncology ( IF 41.6 ) Pub Date : 2019-03-25 , DOI: 10.1016/s1470-2045(19)30020-8 Vicky Makker 1 , Drew Rasco 2 , Nicholas J Vogelzang 3 , Marcia S Brose 4 , Allen L Cohn 5 , James Mier 6 , Christopher Di Simone 7 , David M Hyman 1 , Daniel E Stepan 8 , Corina E Dutcus 8 , Emmett V Schmidt 9 , Matthew Guo 8 , Pallavi Sachdev 8 , Robert Shumaker 8 , Carol Aghajanian 1 , Matthew Taylor 10
Affiliation
|
背景
Lenvatinib 是 VEGFR1、VEGFR2 和 VEGFR3 以及其他受体酪氨酸激酶的多激酶抑制剂。Pembrolizumab 是一种靶向 PD-1 的抗体,对生物标志物未选择的子宫内膜癌具有中等疗效。在 1b 期研究中确定最大耐受剂量后,我们旨在评估 lenvatinib 加 pembrolizumab 联合治疗晚期子宫内膜癌患者的疗效。
方法
在美国 11 个中心进行的这项开放标签、单臂、2 期研究中,符合条件的患者年龄在 18 岁或以上,患有转移性子宫内膜癌(未因微卫星不稳定性或 PD-L1 而选择),东部肿瘤合作组体能状态为 0 或 1,既往接受过不超过两次全身治疗,根据实体瘤免疫相关反应评估标准 (irRECIST) 患有可测量的疾病, 预期寿命为 12 周或更长时间。患者每天口服 20 mg lenvatinib 加 200 mg 静脉注射 pembrolizumab,每 3 周一次。治疗持续至疾病进展、出现不可接受的毒性作用或撤回同意。该中期分析的主要终点是研究人员根据 irRECIST 在符合方案的人群中评估的第 24 周时具有客观反应的患者比例。此试用版注册为 ,编号为 。
发现
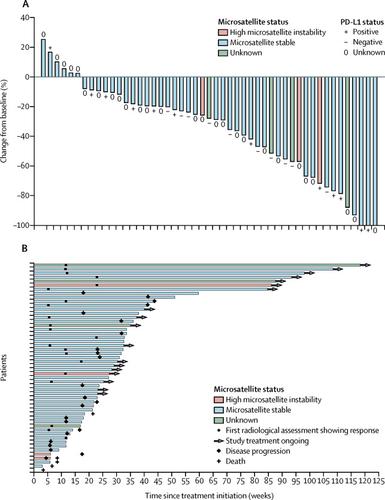
在 2015 年 9 月 10 日至 2017 年 7 月 24 日期间,共纳入 54 名患者,其中 53 名被纳入分析。在抗肿瘤活性数据的截止日期(2017 年 12 月 15 日),中位研究随访为 13·3 个月 (IQR 6·7–20·1)。21 例 (39·6% [95% CI 26·5–54·0]) 患者在第 24 周时有客观反应。16 例 (30%) 患者发生严重治疗相关不良事件,并报告了 1 例治疗相关死亡 (颅内出血)。最常报告的任意级别治疗相关不良事件是高血压 (31 [58%])、疲劳 (29 [55%])、腹泻 (27 [51%])和甲状腺功能减退症 (25 [47%])。最常见的 3 级治疗相关不良事件是高血压 (18 例 [34%]) 和腹泻 (4 例 [8%])。未报告与 4 级治疗相关的不良事件。5 例 (9%) 患者因治疗相关不良事件而停止研究治疗。
解释
Lenvatinib 联合 pembrolizumab 在晚期复发性子宫内膜癌患者中显示出抗肿瘤活性,除了甲状腺功能减退症的频率增加外,其安全性与先前报道的 lenvatinib 和 pembrolizumab 单药治疗相似。Lenvatinib 联合 pembrolizumab 可能代表该患者群体的新的潜在治疗选择,并且正在一项随机 3 期研究中进行研究。
资金
卫材和默克。
"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号