当前位置:
X-MOL 学术
›
STEM CELLS
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Bmi1 Overexpression in Mesenchymal Stem Cells Exerts Anti-Aging and Anti-Osteoporosis Effects by Inactivating p16/p19 Signaling And Inhibiting Oxidative Stress
STEM CELLS ( IF 4.0 ) Pub Date : 2019-06-19 , DOI: 10.1002/stem.3007
Guangpei Chen 1, 2 , Ying Zhang 2, 3 , Shuxiang Yu 2 , Wen Sun 2 , Dengshun Miao 2, 4
STEM CELLS ( IF 4.0 ) Pub Date : 2019-06-19 , DOI: 10.1002/stem.3007
Guangpei Chen 1, 2 , Ying Zhang 2, 3 , Shuxiang Yu 2 , Wen Sun 2 , Dengshun Miao 2, 4
Affiliation
|
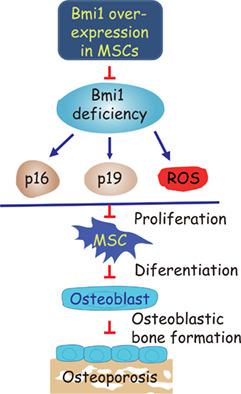
We previously demonstrated that Bmi1 deficiency leads to osteoporosis phenotype by inhibiting the proliferation and osteogenic differentiation of bone marrow mesenchymal stem cells (MSCs), but it is unclear whether overexpression of Bmi1 in MSCs stimulates skeletal development and rescues Bmi1 deficiency‐induced osteoporosis. To answer this question, we constructed transgenic mice (Bmi1Tg) that overexpressed Bmi1 driven by the Prx1 gene and analyzed their skeletal phenotype differences with that of wild‐type littermates. We then hybridized Bmi1Tg to Bmi1−/− mice to generate Bmi1−/− mice overexpressing Bmi1 in MSCs and compared their skeletal phenotypes with those of Bmi1−/− and wild‐type mice using imaging, histopathological, immunohistochemical, histomorphometric, cellular, and molecular methods. Bmi1Tg mice exhibited enhanced bone growth and osteoblast formation, including the augmentation of bone size, cortical and trabecular volume, number of osteoblasts, alkaline phosphatase (ALP)‐positive and type I collagen‐positive areas, number of total colony forming unit fibroblasts (CFU‐f) and ALP+ CFU‐f, and osteogenic gene expression levels. Consistently, MSC overexpressing Bmi1 in the Bmi1−/− background not only largely reversed Bmi1 systemic deficiency‐induced skeletal growth retardation and osteoporosis, but also partially reversed Bmi1 deficiency‐induced systemic growth retardation and premature aging. To further explore the mechanism of action of MSCs overexpressing Bmi1 in antiosteoporosis and antiaging, we examined changes in oxidative stress and expression levels of p16 and p19. Our results showed that overexpression of Bmi1 in MSCs inhibited oxidative stress and downregulated p16 and p19. Taken together, the results of this study indicate that overexpression of Bmi1 in MSCs exerts antiaging and antiosteoporosis effects by inactivating p16/p19 signaling and inhibiting oxidative stress. Stem Cells 2019;37:1200–1211
中文翻译:

间充质干细胞中的 Bmi1 过表达通过灭活 p16/p19 信号和抑制氧化应激发挥抗衰老和抗骨质疏松作用
我们以前证明 Bmi1 缺乏通过抑制骨髓间充质干细胞 (MSC) 的增殖和成骨分化导致骨质疏松表型,但尚不清楚 Bmi1 在 MSC 中的过表达是否刺激骨骼发育并挽救 Bmi1 缺乏引起的骨质疏松症。为了回答这个问题,我们构建了由 Prx1 基因驱动的过表达 Bmi1 的转基因小鼠(Bmi1Tg),并分析了它们与野生型同窝仔的骨骼表型差异。然后,我们将 Bmi1Tg 与 Bmi1-/- 小鼠杂交以产生在 MSC 中过表达 Bmi1 的 Bmi1-/- 小鼠,并使用成像、组织病理学、免疫组织化学、组织形态学、细胞和分子方法。Bmi1Tg 小鼠表现出增强的骨生长和成骨细胞形成,包括骨大小、皮质和小梁体积、成骨细胞数量、碱性磷酸酶 (ALP) 阳性和 I 型胶原阳性区域、总集落形成单位成纤维细胞 (CFU) 数量的增加‐f) 和 ALP+ CFU‐f,以及成骨基因表达水平。一致地,在 Bmi1-/- 背景中过表达 Bmi1 的 MSC 不仅在很大程度上逆转了 Bmi1 全身性缺乏引起的骨骼生长迟缓和骨质疏松症,而且还部分逆转了 Bmi1 缺乏引起的全身性生长迟缓和过早衰老。为了进一步探索过表达 Bmi1 的 MSC 在抗骨质疏松和抗衰老中的作用机制,我们检查了氧化应激和 p16 和 p19 表达水平的变化。我们的结果表明,MSCs 中 Bmi1 的过表达抑制了氧化应激并下调了 p16 和 p19。总之,本研究的结果表明,MSCs 中 Bmi1 的过表达通过使 p16/p19 信号传导失活和抑制氧化应激来发挥抗衰老和抗骨质疏松作用。干细胞 2019;37:1200–1211
更新日期:2019-06-19
中文翻译:

间充质干细胞中的 Bmi1 过表达通过灭活 p16/p19 信号和抑制氧化应激发挥抗衰老和抗骨质疏松作用
我们以前证明 Bmi1 缺乏通过抑制骨髓间充质干细胞 (MSC) 的增殖和成骨分化导致骨质疏松表型,但尚不清楚 Bmi1 在 MSC 中的过表达是否刺激骨骼发育并挽救 Bmi1 缺乏引起的骨质疏松症。为了回答这个问题,我们构建了由 Prx1 基因驱动的过表达 Bmi1 的转基因小鼠(Bmi1Tg),并分析了它们与野生型同窝仔的骨骼表型差异。然后,我们将 Bmi1Tg 与 Bmi1-/- 小鼠杂交以产生在 MSC 中过表达 Bmi1 的 Bmi1-/- 小鼠,并使用成像、组织病理学、免疫组织化学、组织形态学、细胞和分子方法。Bmi1Tg 小鼠表现出增强的骨生长和成骨细胞形成,包括骨大小、皮质和小梁体积、成骨细胞数量、碱性磷酸酶 (ALP) 阳性和 I 型胶原阳性区域、总集落形成单位成纤维细胞 (CFU) 数量的增加‐f) 和 ALP+ CFU‐f,以及成骨基因表达水平。一致地,在 Bmi1-/- 背景中过表达 Bmi1 的 MSC 不仅在很大程度上逆转了 Bmi1 全身性缺乏引起的骨骼生长迟缓和骨质疏松症,而且还部分逆转了 Bmi1 缺乏引起的全身性生长迟缓和过早衰老。为了进一步探索过表达 Bmi1 的 MSC 在抗骨质疏松和抗衰老中的作用机制,我们检查了氧化应激和 p16 和 p19 表达水平的变化。我们的结果表明,MSCs 中 Bmi1 的过表达抑制了氧化应激并下调了 p16 和 p19。总之,本研究的结果表明,MSCs 中 Bmi1 的过表达通过使 p16/p19 信号传导失活和抑制氧化应激来发挥抗衰老和抗骨质疏松作用。干细胞 2019;37:1200–1211

































 京公网安备 11010802027423号
京公网安备 11010802027423号