当前位置:
X-MOL 学术
›
ACS Appl. Mater. Interfaces
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Gene-Embedded Nanostructural Biotic–Abiotic Optoelectrode Arrays Applied for Synchronous Brain Optogenetics and Neural Signal Recording
ACS Applied Materials & Interfaces ( IF 8.3 ) Pub Date : 2019-03-07 00:00:00 , DOI: 10.1021/acsami.9b03264 Wei-Chen Huang,Hui-Shang Chi,Yi-Chao Lee,Yu-Chun Lo,Ta-Chung Liu,Min-Yu Chiang,Hsu-Yan Chen,Ssu-Ju Li,You-Yin Chen,San-Yuan Chen
ACS Applied Materials & Interfaces ( IF 8.3 ) Pub Date : 2019-03-07 00:00:00 , DOI: 10.1021/acsami.9b03264 Wei-Chen Huang,Hui-Shang Chi,Yi-Chao Lee,Yu-Chun Lo,Ta-Chung Liu,Min-Yu Chiang,Hsu-Yan Chen,Ssu-Ju Li,You-Yin Chen,San-Yuan Chen
|
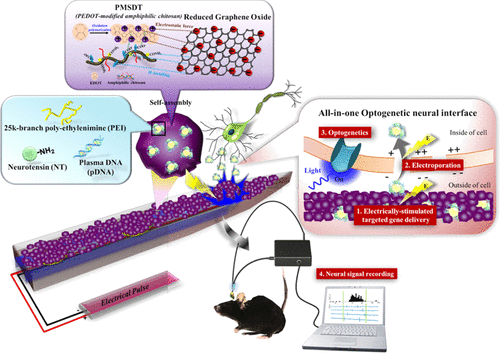
Optogenetics is a recently established neuromodulation technique in which photostimulation is used to manipulate neurons with high temporal and spatial precision. However, sequential genetic and optical insertion with double brain implantation tends to cause excessive tissue damage. In addition, the incorporation of light-sensitive genes requires the utilization of viral vectors, which remains a safety concern. Here, by combining device fabrication design, nanotechnology, and cell targeting technology, we developed a new gene-embedded optoelectrode array for neural implantation to enable spatiotemporal electroporation (EP) for gene delivery/transfection, photomodulation, and synchronous electrical monitoring of neural signals in the brain via one-time implantation. A biotic–abiotic neural interface (called PG) composed of reduced graphene oxide and conductive polyelectrolyte 3,4-ethylenedioxythiophene-modified amphiphilic chitosan was developed to form a nanostructural hydrogel with assembled nanodomains for encapsulating nonviral gene vectors (called PEI–NT–pDNA) formulated by neurotensin (NT) and polyethylenimine (PEI)-coupled plasmid DNA (pDNA). The PG can maintain high charge storage ability to respond to a minimal current of 125 μA for controllable gene delivery. The in vitro analysis of PG–PEI–NT–pDNA on the microelectrode array chip showed that the microelectrodes provided electrically inductive electropermeabilization, which permitted gene transfection into localized rat adrenal pheochromocytoma cells with a strong green fluorescent protein expression that was up to 8-fold higher than that in nontreated cells. Furthermore, the in vivo implantation enabled on-demand spatiotemporal gene transfection to neurons with 10-fold enhancement of targeting ability compared with astrocytes. Finally, using the real optogenetic opsin channelrhodopsin-2, the flexible neural probe incorporated with an optical waveguide fiber displayed photoevoked extracellular spikes in the thalamic ventrobasal region after focal EP for only 7 days, which provided a proof of concept for the use of photomodulation to facilitate neural therapies.
中文翻译:

基因嵌入的纳米结构生物非生物光电电极阵列用于同步脑光遗传学和神经信号记录
光遗传学是最近建立的神经调节技术,其中光刺激用于以高的时间和空间精度来操纵神经元。然而,通过双脑植入的顺序遗传和光学插入往往会导致过度的组织损伤。另外,光敏基因的掺入需要利用病毒载体,这仍然是安全问题。在这里,通过结合设备制造设计,纳米技术和细胞靶向技术,我们开发了一种用于神经植入的新的基因嵌入光电电极阵列,以使时空电穿孔(EP)能够进行基因传递/转染,光调制和同步电监控神经信号。通过一次性植入大脑。开发了一种由还原性氧化石墨烯和导电聚电解质3,4-乙二氧基噻吩修饰的两亲性壳聚糖组成的生物非生物神经界面(称为PG),以形成具有组装的纳米域的纳米结构水凝胶,用于封装非病毒基因载体(称为PEI–NT–pDNA)。由神经降压素(NT)和聚乙烯亚胺(PEI)偶联的质粒DNA(pDNA)配制。PG可以保持高电荷存储能力,以响应125μA的最小电流以控制基因传递。在微电极阵列芯片上对PG–PEI–NT–pDNA的体外分析表明,微电极提供了电感应电通透性,可以将基因转染到局部大鼠肾上腺嗜铬细胞瘤细胞中,绿色荧光蛋白表达强,比未处理的细胞高8倍。此外,与星形胶质细胞相比,体内植入使按需时空基因转染至神经元具有增强了10倍的靶向能力。最后,使用真正的光遗传视蛋白通道视紫红质2,结合了光导纤维的柔性神经探针在局灶性EP后仅7天就显示了丘脑腹基底区的光诱发的细胞外尖峰,这提供了使用光调制技术进行光调制的概念验证。促进神经疗法。与星形胶质细胞相比,体内植入使按需时空基因转染至神经元具有增强了10倍的靶向能力。最后,使用真正的光遗传视蛋白通道视紫红质2,结合了光导纤维的柔性神经探针在局灶性EP后仅7天就显示了丘脑腹基底区的光诱发的细胞外尖峰,这提供了使用光调制技术进行光调制的概念验证。促进神经疗法。与星形胶质细胞相比,体内植入使按需时空基因转染至神经元具有增强了10倍的靶向能力。最后,使用真正的光遗传视蛋白通道视紫红质2,结合了光导纤维的柔性神经探针在局灶性EP后仅7天就显示了丘脑腹基底区的光诱发的细胞外尖峰,这提供了使用光调制技术进行光调制的概念验证。促进神经疗法。
更新日期:2019-03-07
中文翻译:

基因嵌入的纳米结构生物非生物光电电极阵列用于同步脑光遗传学和神经信号记录
光遗传学是最近建立的神经调节技术,其中光刺激用于以高的时间和空间精度来操纵神经元。然而,通过双脑植入的顺序遗传和光学插入往往会导致过度的组织损伤。另外,光敏基因的掺入需要利用病毒载体,这仍然是安全问题。在这里,通过结合设备制造设计,纳米技术和细胞靶向技术,我们开发了一种用于神经植入的新的基因嵌入光电电极阵列,以使时空电穿孔(EP)能够进行基因传递/转染,光调制和同步电监控神经信号。通过一次性植入大脑。开发了一种由还原性氧化石墨烯和导电聚电解质3,4-乙二氧基噻吩修饰的两亲性壳聚糖组成的生物非生物神经界面(称为PG),以形成具有组装的纳米域的纳米结构水凝胶,用于封装非病毒基因载体(称为PEI–NT–pDNA)。由神经降压素(NT)和聚乙烯亚胺(PEI)偶联的质粒DNA(pDNA)配制。PG可以保持高电荷存储能力,以响应125μA的最小电流以控制基因传递。在微电极阵列芯片上对PG–PEI–NT–pDNA的体外分析表明,微电极提供了电感应电通透性,可以将基因转染到局部大鼠肾上腺嗜铬细胞瘤细胞中,绿色荧光蛋白表达强,比未处理的细胞高8倍。此外,与星形胶质细胞相比,体内植入使按需时空基因转染至神经元具有增强了10倍的靶向能力。最后,使用真正的光遗传视蛋白通道视紫红质2,结合了光导纤维的柔性神经探针在局灶性EP后仅7天就显示了丘脑腹基底区的光诱发的细胞外尖峰,这提供了使用光调制技术进行光调制的概念验证。促进神经疗法。与星形胶质细胞相比,体内植入使按需时空基因转染至神经元具有增强了10倍的靶向能力。最后,使用真正的光遗传视蛋白通道视紫红质2,结合了光导纤维的柔性神经探针在局灶性EP后仅7天就显示了丘脑腹基底区的光诱发的细胞外尖峰,这提供了使用光调制技术进行光调制的概念验证。促进神经疗法。与星形胶质细胞相比,体内植入使按需时空基因转染至神经元具有增强了10倍的靶向能力。最后,使用真正的光遗传视蛋白通道视紫红质2,结合了光导纤维的柔性神经探针在局灶性EP后仅7天就显示了丘脑腹基底区的光诱发的细胞外尖峰,这提供了使用光调制技术进行光调制的概念验证。促进神经疗法。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号