当前位置:
X-MOL 学术
›
ACS Synth. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Designing of a Cofactor Self-Sufficient Whole-Cell Biocatalyst System for Production of 1,2-Amino Alcohols from Epoxides.
ACS Synthetic Biology ( IF 3.7 ) Pub Date : 2019-03-12 , DOI: 10.1021/acssynbio.8b00364
Song Liu 1 , Xian Zhang 1 , Fei Liu 1 , Meijuan Xu 1 , Taowei Yang 1 , Mengfei Long 1 , Junping Zhou 1 , Tolbert Osire 1 , Shangtian Yang 2 , Zhiming Rao 1
ACS Synthetic Biology ( IF 3.7 ) Pub Date : 2019-03-12 , DOI: 10.1021/acssynbio.8b00364
Song Liu 1 , Xian Zhang 1 , Fei Liu 1 , Meijuan Xu 1 , Taowei Yang 1 , Mengfei Long 1 , Junping Zhou 1 , Tolbert Osire 1 , Shangtian Yang 2 , Zhiming Rao 1
Affiliation
|
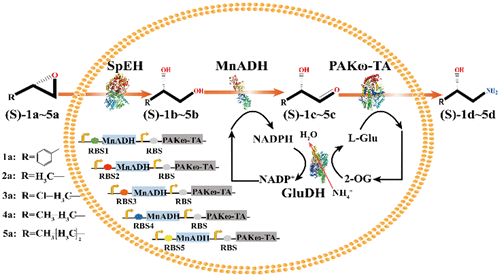
Optically pure 1,2-amino alcohols are highly valuable products as intermediates for chiral pharmaceutical products. Here we designed an environmentally friendly non-natural biocatalytic cascade for efficient synthesis of 1,2-amino alcohols from cheaper epoxides. A redesignated ω-transaminase PAKω-TA was tested and showed good bioactivity at a lower pH than other reported transaminases. The cascade was efficiently constructed as a single one-pot E. coli recombinant, by coupling SpEH (epoxide hydrolase), MnADH (alcohol dehydrogenase), and PAKω-TA. Furthermore, RBS regulation strategy was used to overcome the rate limiting step by increasing expression of MnADH. For cofactor regeneration and amino donor source, an interesting point was involved as that a cofactor self-sufficient system was designed by expression of GluDH. It established a "bridge" between the cofactor and the cosubstrate, such that the cofactor self-sufficient system could release cofactor (NADP+) and cosubstrate (l-Glutamine) regenerated simultaneously. The recombinant E. coli BL21 (SGMP) with cofactor self-sufficient whole-cell cascade biocatalysis showed high ee value (>99%) and high yield, with 99.6% conversion of epoxide ( S)-1a to 1,2-amino alcohol ( S)-1d in 10 h. It further converted ( S)-2a-5a to ( S)-2d-5d with varying conversion rates ranging between 65-96.4%. This study first provides one-step synthesis of optically pure 1,2-amino alcohols from ( S)-epoxides employing a synthetic redox-self-sufficient cascade.
中文翻译:

从环氧化物生产1,2-氨基醇的辅因子自足全细胞生物催化剂系统的设计。
光学纯的1,2-氨基醇作为手性药物产品的中间体,是非常有价值的产品。在这里,我们设计了一种环境友好的非天然生物催化级联反应,用于从廉价的环氧化物高效合成1,2-氨基醇。测试了重新指定的ω-转氨酶PAKω-TA,并在比其他报道的转氨酶更低的pH值下显示了良好的生物活性。通过偶联SpEH(环氧水解酶),MnADH(酒精脱氢酶)和PAKω-TA,将级联有效地构建为一个单罐大肠杆菌重组体。此外,RBS调节策略用于通过增加MnADH的表达来克服限速步骤。对于辅因子再生和氨基供体来源,涉及一个有趣的观点,因为通过表达GluDH设计了辅因子自足系统。它建立了一个“ 具有辅助因子自足的全细胞级联生物催化作用的重组大肠杆菌BL21(SGMP)具有较高的ee值(> 99%)和高的产率,其中环氧化物(S)-1a转化为1,2-氨基醇的比例为99.6% (S)-1d在10小时内。它进一步将(S)-2a-5a转化为(S)-2d-5d,转化率在65-96.4%之间。这项研究首先提供了使用合成的氧化还原自足级联反应从(S)-环氧化物一步合成光学纯的1,2-氨基醇的方法。具有辅助因子自足的全细胞级联生物催化作用的重组大肠杆菌BL21(SGMP)具有较高的ee值(> 99%)和高的产率,其中环氧化物(S)-1a转化为1,2-氨基醇的比例为99.6% (S)-1d在10小时内。它进一步将(S)-2a-5a转化为(S)-2d-5d,转化率在65-96.4%之间。这项研究首先提供了使用合成的氧化还原自足级联反应从(S)-环氧化物一步合成光学纯的1,2-氨基醇的方法。
更新日期:2019-03-06
中文翻译:

从环氧化物生产1,2-氨基醇的辅因子自足全细胞生物催化剂系统的设计。
光学纯的1,2-氨基醇作为手性药物产品的中间体,是非常有价值的产品。在这里,我们设计了一种环境友好的非天然生物催化级联反应,用于从廉价的环氧化物高效合成1,2-氨基醇。测试了重新指定的ω-转氨酶PAKω-TA,并在比其他报道的转氨酶更低的pH值下显示了良好的生物活性。通过偶联SpEH(环氧水解酶),MnADH(酒精脱氢酶)和PAKω-TA,将级联有效地构建为一个单罐大肠杆菌重组体。此外,RBS调节策略用于通过增加MnADH的表达来克服限速步骤。对于辅因子再生和氨基供体来源,涉及一个有趣的观点,因为通过表达GluDH设计了辅因子自足系统。它建立了一个“ 具有辅助因子自足的全细胞级联生物催化作用的重组大肠杆菌BL21(SGMP)具有较高的ee值(> 99%)和高的产率,其中环氧化物(S)-1a转化为1,2-氨基醇的比例为99.6% (S)-1d在10小时内。它进一步将(S)-2a-5a转化为(S)-2d-5d,转化率在65-96.4%之间。这项研究首先提供了使用合成的氧化还原自足级联反应从(S)-环氧化物一步合成光学纯的1,2-氨基醇的方法。具有辅助因子自足的全细胞级联生物催化作用的重组大肠杆菌BL21(SGMP)具有较高的ee值(> 99%)和高的产率,其中环氧化物(S)-1a转化为1,2-氨基醇的比例为99.6% (S)-1d在10小时内。它进一步将(S)-2a-5a转化为(S)-2d-5d,转化率在65-96.4%之间。这项研究首先提供了使用合成的氧化还原自足级联反应从(S)-环氧化物一步合成光学纯的1,2-氨基醇的方法。































 京公网安备 11010802027423号
京公网安备 11010802027423号