Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
内在失调的小麦LEA_4蛋白TdLEA3的结构特性和酶稳定功能
Scientific Reports ( IF 3.8 ) Pub Date : 2019-03-06 , DOI: 10.1038/s41598-019-39823-w Sana Koubaa , Anne Bremer , Dirk K. Hincha , Faiçal Brini

"点击查看英文标题和摘要"
更新日期:2019-03-06
Scientific Reports ( IF 3.8 ) Pub Date : 2019-03-06 , DOI: 10.1038/s41598-019-39823-w Sana Koubaa , Anne Bremer , Dirk K. Hincha , Faiçal Brini
|
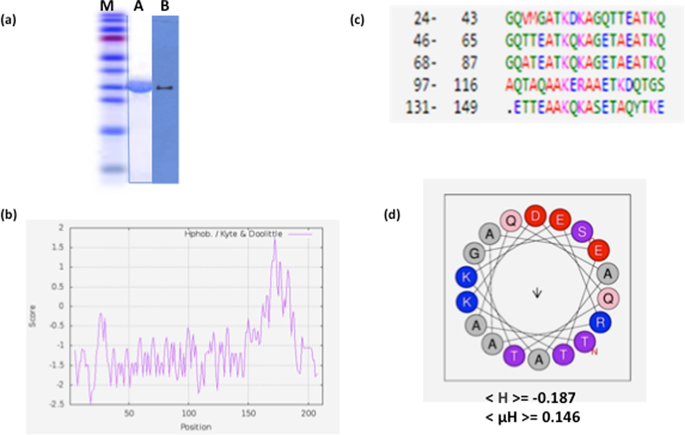
晚期胚胎发生丰富(LEA)蛋白通常被预测为在细胞脱水条件下诱导的内在无序蛋白(IDP)。然而,它们的功能很大程度上尚未被开发,并且它们的结构以及与潜在靶分子的相互作用只是最近才在少量蛋白质中进行了研究。在这里,我们表征了小麦LEA蛋白TdLEA3,它与以11-mer重复基序TAQAAKEKAXE为特征的LEA_4蛋白组具有序列同源性。TdLEA3具有这个不完全保守的11-mer氨基酸基序的5个重复序列。为了研究蛋白质的结构,我们使用了圆二色性(CD)和傅立叶变换红外(FTIR)光谱。数据表明,TdLEA3在完全水合条件下无序,并且在干燥和三氟乙醇(TFE)存在下获得α-螺旋结构。此外,在蛋白质溶液中增加甘油浓度会导致α-螺旋含量的逐步增加。活性分析表明,TdLEA3能够防止在加热,脱水-脱水和冻融处理下乳酸脱氢酶(LDH)的失活。此外,在这些处理过程中,TdLEA3减少了酶中聚集体的形成。活性分析表明,TdLEA3能够防止在加热,脱水-脱水和冻融处理下乳酸脱氢酶(LDH)的失活。此外,在这些处理过程中,TdLEA3减少了酶中聚集体的形成。活性分析表明,TdLEA3能够防止在加热,脱水-脱水和冻融处理下乳酸脱氢酶(LDH)的失活。此外,在这些处理过程中,TdLEA3减少了酶中聚集体的形成。

"点击查看英文标题和摘要"




















































 京公网安备 11010802027423号
京公网安备 11010802027423号