当前位置:
X-MOL 学术
›
Cell Chem. Bio.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Characterization, Dynamics, and Mechanism of CXCR4 Antagonists on a Constitutively Active Mutant.
Cell Chemical Biology ( IF 6.6 ) Pub Date : 2019-02-28 , DOI: 10.1016/j.chembiol.2019.01.012 Eric M. Rosenberg , Reed E.S. Harrison , Lun Kelvin Tsou , Natalie Drucker , Brock Humphries , Deepa Rajasekaran , Kathryn E. Luker , Chien-Huang Wu , Jen-Shin Song , Chuan-Jen Wang , James W. Murphy , Yung-Chi Cheng , Kak-Shan Shia , Gary D. Luker , Dimitrios Morikis , Elias J. Lolis
Cell Chemical Biology ( IF 6.6 ) Pub Date : 2019-02-28 , DOI: 10.1016/j.chembiol.2019.01.012 Eric M. Rosenberg , Reed E.S. Harrison , Lun Kelvin Tsou , Natalie Drucker , Brock Humphries , Deepa Rajasekaran , Kathryn E. Luker , Chien-Huang Wu , Jen-Shin Song , Chuan-Jen Wang , James W. Murphy , Yung-Chi Cheng , Kak-Shan Shia , Gary D. Luker , Dimitrios Morikis , Elias J. Lolis
|
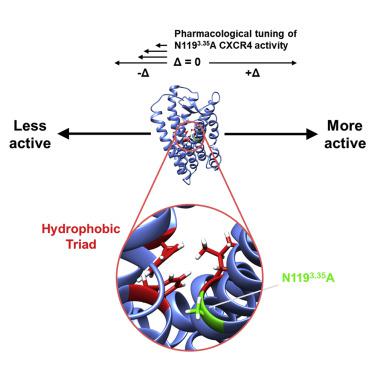
The G protein-coupled receptor (GPCR) CXCR4 is a co-receptor for HIV and is involved in cancers and autoimmune diseases. We characterized five purine or quinazoline core polyamine pharmacophores used for targeting CXCR4 dysregulation in diseases. All were neutral antagonists for wild-type CXCR4 and two were biased antagonists with effects on β-arrestin-2 only at high concentrations. These compounds displayed various activities for a constitutively active mutant (CAM). We use the IT1t-CXCR4 crystal structure and molecular dynamics (MD) simulations to develop two hypotheses for the activation of the N1193.35A CAM. The N1193.35A mutation facilitates increased coupling of TM helices III and VI. IT1t deactivates the CAM by disrupting the coupling between TM helices III and VI, mediated primarily by residue F872.53. Mutants of F872.53 in N1193.35A CXCR4 precluded constitutive signaling and prevented inverse agonism. This work characterizes CXCR4 ligands and provides a mechanism for N1193.35A constitutive activation.
中文翻译:

CXCR4 拮抗剂对组成型活性突变体的表征、动力学和机制。
G 蛋白偶联受体 (GPCR) CXCR4 是 HIV 的共同受体,与癌症和自身免疫性疾病有关。我们表征了五种用于靶向疾病中 CXCR4 失调的嘌呤或喹唑啉核心多胺药效团。所有这些都是野生型 CXCR4 的中性拮抗剂,两种是偏向拮抗剂,仅在高浓度时对 β-arrestin-2 产生作用。这些化合物对于组成型活性突变体(CAM)表现出多种活性。我们使用 IT1t-CXCR4 晶体结构和分子动力学 (MD) 模拟来开发 N1193.35A CAM 激活的两种假设。 N1193.35A 突变促进 TM 螺旋 III 和 VI 的偶联增加。 IT1t 通过破坏主要由残基 F872.53 介导的 TM 螺旋 III 和 VI 之间的偶联来使 CAM 失活。 N1193.35A CXCR4 中的 F872.53 突变体排除了组成型信号传导并阻止了反向激动。这项工作表征了 CXCR4 配体并提供了 N1193.35A 组成型激活的机制。
更新日期:2019-05-16
中文翻译:

CXCR4 拮抗剂对组成型活性突变体的表征、动力学和机制。
G 蛋白偶联受体 (GPCR) CXCR4 是 HIV 的共同受体,与癌症和自身免疫性疾病有关。我们表征了五种用于靶向疾病中 CXCR4 失调的嘌呤或喹唑啉核心多胺药效团。所有这些都是野生型 CXCR4 的中性拮抗剂,两种是偏向拮抗剂,仅在高浓度时对 β-arrestin-2 产生作用。这些化合物对于组成型活性突变体(CAM)表现出多种活性。我们使用 IT1t-CXCR4 晶体结构和分子动力学 (MD) 模拟来开发 N1193.35A CAM 激活的两种假设。 N1193.35A 突变促进 TM 螺旋 III 和 VI 的偶联增加。 IT1t 通过破坏主要由残基 F872.53 介导的 TM 螺旋 III 和 VI 之间的偶联来使 CAM 失活。 N1193.35A CXCR4 中的 F872.53 突变体排除了组成型信号传导并阻止了反向激动。这项工作表征了 CXCR4 配体并提供了 N1193.35A 组成型激活的机制。































 京公网安备 11010802027423号
京公网安备 11010802027423号