当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Autophagy and endosomal trafficking inhibition by Vibrio cholerae MARTX toxin phosphatidylinositol-3-phosphate-specific phospholipase A1 activity.
Nature Communications ( IF 14.7 ) Pub Date : 2015-Oct-26 , DOI: 10.1038/ncomms9745 Shivani Agarwal 1 , Hyunjin Kim 2 , Robin B Chan 3 , Shivangi Agarwal 1 , Rebecca Williamson 3 , Wonhwa Cho 2 , Gilbert Di Paolo 3 , Gilbert D Paolo 3 , Karla J F Satchell 1
Nature Communications ( IF 14.7 ) Pub Date : 2015-Oct-26 , DOI: 10.1038/ncomms9745 Shivani Agarwal 1 , Hyunjin Kim 2 , Robin B Chan 3 , Shivangi Agarwal 1 , Rebecca Williamson 3 , Wonhwa Cho 2 , Gilbert Di Paolo 3 , Gilbert D Paolo 3 , Karla J F Satchell 1
Affiliation
|
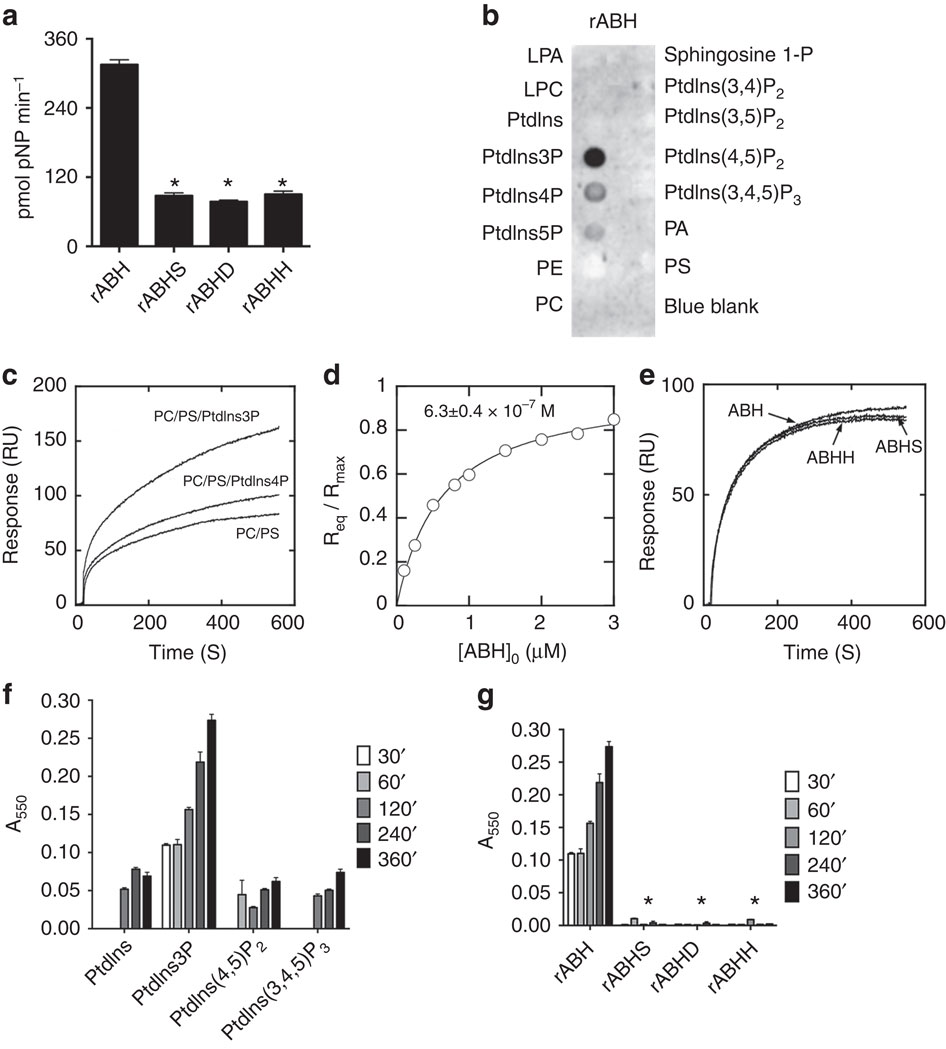
Vibrio cholerae, responsible for acute gastroenteritis secretes a large multifunctional-autoprocessing repeat-in-toxin (MARTX) toxin linked to evasion of host immune system, facilitating colonization of small intestine. Unlike other effector domains of the multifunctional toxin that target cytoskeleton, the function of alpha-beta hydrolase (ABH) remained elusive. This study demonstrates that ABH is an esterase/lipase with catalytic Ser-His-Asp triad. ABH binds with high affinity to phosphatidylinositol-3-phosphate (PtdIns3P) and cleaves the fatty acid in PtdIns3P at the sn1 position in vitro making it the first PtdIns3P-specific phospholipase A1 (PLA1). Expression of ABH in vivo reduces intracellular PtdIns3P levels and its PtdIns3P-specific PLA1 activity blocks endosomal and autophagic pathways. In accordance with recent studies acknowledging the potential of extracellular pathogens to evade or exploit autophagy to prevent their clearance and facilitate survival, this is the first report highlighting the role of ABH in inhibiting autophagy and endosomal trafficking induced by extracellular V. cholerae.
中文翻译:

霍乱弧菌MARTX毒素磷脂酰肌醇-3-磷酸特异性磷脂酶A1活性抑制自噬和内体运输。
导致急性肠胃炎的霍乱弧菌分泌一种大型的多功能自动加工重复毒素(MARTX)毒素,与逃避宿主免疫系统有关,促进小肠的定植。与靶向细胞骨架的多功能毒素的其他效应域不同,α-β 水解酶 (ABH) 的功能仍然难以捉摸。该研究表明 ABH 是一种具有催化 Ser-His-Asp 三联体的酯酶/脂肪酶。ABH 与 3-磷酸磷脂酰肌醇 (PtdIns3P) 具有高亲和力结合,并在体外裂解 PtdIns3P 中 sn1 位置的脂肪酸,使其成为第一个 PtdIns3P 特异性磷脂酶 A1 (PLA1)。ABH 在体内的表达降低了细胞内 PtdIns3P 水平,其 PtdIns3P 特异性 PLA1 活性阻断了内体和自噬途径。
更新日期:2015-10-29
中文翻译:

霍乱弧菌MARTX毒素磷脂酰肌醇-3-磷酸特异性磷脂酶A1活性抑制自噬和内体运输。
导致急性肠胃炎的霍乱弧菌分泌一种大型的多功能自动加工重复毒素(MARTX)毒素,与逃避宿主免疫系统有关,促进小肠的定植。与靶向细胞骨架的多功能毒素的其他效应域不同,α-β 水解酶 (ABH) 的功能仍然难以捉摸。该研究表明 ABH 是一种具有催化 Ser-His-Asp 三联体的酯酶/脂肪酶。ABH 与 3-磷酸磷脂酰肌醇 (PtdIns3P) 具有高亲和力结合,并在体外裂解 PtdIns3P 中 sn1 位置的脂肪酸,使其成为第一个 PtdIns3P 特异性磷脂酶 A1 (PLA1)。ABH 在体内的表达降低了细胞内 PtdIns3P 水平,其 PtdIns3P 特异性 PLA1 活性阻断了内体和自噬途径。





















































 京公网安备 11010802027423号
京公网安备 11010802027423号