Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Structure of the complex I-like molecule NDH of oxygenic photosynthesis
Nature ( IF 50.5 ) Pub Date : 2019-02-01 , DOI: 10.1038/s41586-019-0921-0
Thomas G. Laughlin , Andrew N. Bayne , Jean-François Trempe , David F. Savage , Karen M. Davies
Nature ( IF 50.5 ) Pub Date : 2019-02-01 , DOI: 10.1038/s41586-019-0921-0
Thomas G. Laughlin , Andrew N. Bayne , Jean-François Trempe , David F. Savage , Karen M. Davies
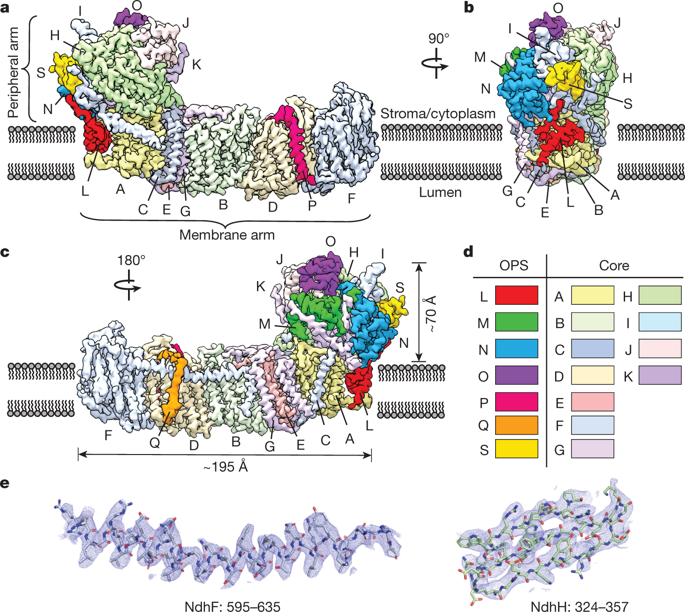
|
Cyclic electron flow around photosystem I (PSI) is a mechanism by which photosynthetic organisms balance the levels of ATP and NADPH necessary for efficient photosynthesis1,2. NAD(P)H dehydrogenase-like complex (NDH) is a key component of this pathway in most oxygenic photosynthetic organisms3,4 and is the last large photosynthetic membrane-protein complex for which the structure remains unknown. Related to the respiratory NADH dehydrogenase complex (complex I), NDH transfers electrons originating from PSI to the plastoquinone pool while pumping protons across the thylakoid membrane, thereby increasing the amount of ATP produced per NADP+ molecule reduced4,5. NDH possesses 11 of the 14 core complex I subunits, as well as several oxygenic-photosynthesis-specific (OPS) subunits that are conserved from cyanobacteria to plants3,6. However, the three core complex I subunits that are involved in accepting electrons from NAD(P)H are notably absent in NDH3,5,6, and it is therefore not clear how NDH acquires and transfers electrons to plastoquinone. It is proposed that the OPS subunits—specifically NdhS—enable NDH to accept electrons from its electron donor, ferredoxin3–5,7. Here we report a 3.1 Å structure of the 0.42-MDa NDH complex from the thermophilic cyanobacterium Thermosynechococcus elongatus BP-1, obtained by single-particle cryo-electron microscopy. Our maps reveal the structure and arrangement of the principal OPS subunits in the NDH complex, as well as an unexpected cofactor close to the plastoquinone-binding site in the peripheral arm. The location of the OPS subunits supports a role in electron transfer and defines two potential ferredoxin-binding sites at the apex of the peripheral arm. These results suggest that NDH could possess several electron transfer routes, which would serve to maximize plastoquinone reduction and avoid deleterious off-target chemistry of the semi-plastoquinone radical.The structure of NDH, a photosynthetic membrane-protein complex that is related to respiratory complex I, is obtained by single-particle cryo-electron microscopy.
中文翻译:

含氧光合作用的复合 I 样分子 NDH 的结构
光系统 I (PSI) 周围的循环电子流是光合生物平衡高效光合作用所需的 ATP 和 NADPH 水平的一种机制1,2。NAD(P)H 脱氢酶样复合物 (NDH) 是大多数含氧光合生物 3,4 中该途径的关键组成部分,并且是最后一个结构仍然未知的大型光合膜蛋白复合物。与呼吸性 NADH 脱氢酶复合物(复合物 I)相关,NDH 将来自 PSI 的电子转移到质体醌池,同时将质子泵送穿过类囊体膜,从而增加每个减少的 NADP+ 分子产生的 ATP 量 4,5。NDH 拥有 14 个核心复合体 I 亚基中的 11 个,以及几个从蓝藻到植物保守的含氧光合作用 (OPS) 亚基 3,6。然而,参与从 NAD(P)H 接受电子的三个核心复合物 I 亚基在 NDH3,5,6 中明显不存在,因此不清楚 NDH 如何获得电子并将电子转移到质体醌。建议 OPS 亚基——特别是 NdhS——使 NDH 能够接受来自其电子供体铁氧还蛋白 3-5,7 的电子。在这里,我们报告了 0.42-MDa NDH 复合物的 3.1 Å 结构,该复合物来自嗜热蓝藻细长嗜热链球菌 BP-1,通过单粒子冷冻电子显微镜获得。我们的图谱揭示了 NDH 复合物中主要 OPS 亚基的结构和排列,以及靠近外周臂质体醌结合位点的意外辅助因子。OPS 亚基的位置支持电子转移中的作用,并在外围臂的顶点定义了两个潜在的铁氧还蛋白结合位点。这些结果表明 NDH 可以拥有多种电子转移途径,这将有助于最大限度地还原质体醌并避免半质体醌自由基的有害脱靶化学。 NDH 的结构,一种与呼吸复合物相关的光合膜蛋白复合物I,是通过单粒子冷冻电子显微镜获得的。
更新日期:2019-02-01
中文翻译:

含氧光合作用的复合 I 样分子 NDH 的结构
光系统 I (PSI) 周围的循环电子流是光合生物平衡高效光合作用所需的 ATP 和 NADPH 水平的一种机制1,2。NAD(P)H 脱氢酶样复合物 (NDH) 是大多数含氧光合生物 3,4 中该途径的关键组成部分,并且是最后一个结构仍然未知的大型光合膜蛋白复合物。与呼吸性 NADH 脱氢酶复合物(复合物 I)相关,NDH 将来自 PSI 的电子转移到质体醌池,同时将质子泵送穿过类囊体膜,从而增加每个减少的 NADP+ 分子产生的 ATP 量 4,5。NDH 拥有 14 个核心复合体 I 亚基中的 11 个,以及几个从蓝藻到植物保守的含氧光合作用 (OPS) 亚基 3,6。然而,参与从 NAD(P)H 接受电子的三个核心复合物 I 亚基在 NDH3,5,6 中明显不存在,因此不清楚 NDH 如何获得电子并将电子转移到质体醌。建议 OPS 亚基——特别是 NdhS——使 NDH 能够接受来自其电子供体铁氧还蛋白 3-5,7 的电子。在这里,我们报告了 0.42-MDa NDH 复合物的 3.1 Å 结构,该复合物来自嗜热蓝藻细长嗜热链球菌 BP-1,通过单粒子冷冻电子显微镜获得。我们的图谱揭示了 NDH 复合物中主要 OPS 亚基的结构和排列,以及靠近外周臂质体醌结合位点的意外辅助因子。OPS 亚基的位置支持电子转移中的作用,并在外围臂的顶点定义了两个潜在的铁氧还蛋白结合位点。这些结果表明 NDH 可以拥有多种电子转移途径,这将有助于最大限度地还原质体醌并避免半质体醌自由基的有害脱靶化学。 NDH 的结构,一种与呼吸复合物相关的光合膜蛋白复合物I,是通过单粒子冷冻电子显微镜获得的。

































 京公网安备 11010802027423号
京公网安备 11010802027423号