当前位置:
X-MOL 学术
›
Cell Death Differ.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
通过PPARγ的正反馈调节,HSPA12A是脂肪细胞分化和饮食诱导的肥胖所必需的。
Cell Death and Differentiation ( IF 13.7 ) Pub Date : 2019-02-11 , DOI: 10.1038/s41418-019-0300-2 Xiaojin Zhang 1 , Xuan Chen 2 , Tao Qi 2 , Qiuyue Kong 2 , Hao Cheng 2 , Xiaofei Cao 2 , Yuehua Li 3 , Chuanfu Li 4 , Li Liu 1 , Zhengnian Ding 2
Cell Death and Differentiation ( IF 13.7 ) Pub Date : 2019-02-11 , DOI: 10.1038/s41418-019-0300-2 Xiaojin Zhang 1 , Xuan Chen 2 , Tao Qi 2 , Qiuyue Kong 2 , Hao Cheng 2 , Xiaofei Cao 2 , Yuehua Li 3 , Chuanfu Li 4 , Li Liu 1 , Zhengnian Ding 2
Affiliation
|
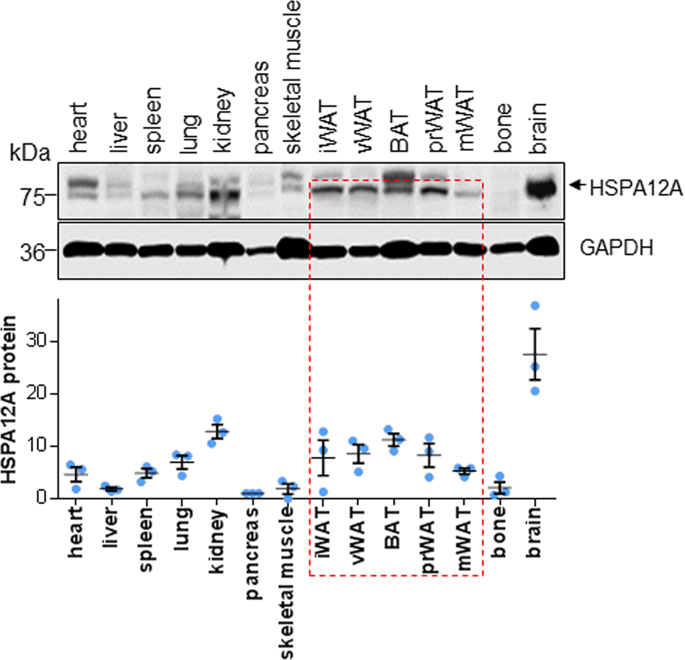
肥胖是最严重的公共卫生问题之一。过氧化物酶体增殖物激活受体γ(PPARγ)在肥胖形成的脂肪细胞分化中起主要作用。然而,尚未开发出最佳的抗肥胖药,需要进行更多的研究以鉴定肥胖病发病机理中的新型调节剂。热激蛋白12A(HSPA12A)编码HSP70家族的一个新成员。在这里,我们报道肥胖患者的脂肪HSPA12A表达增加,这与体重指数的增加呈正相关。有趣的是,与野生型(WT)同窝仔猪相比,在小鼠中敲除HSPA12A(Hspa12a-/-)可以减轻高脂饮食(HFD)引起的体重增加,肥胖,高脂血症和高血糖。与WT小鼠相比,在Hspa12a-/-小鼠中观察到胰岛素敏感性增加。HFD诱导的Hspa12a-/-小鼠白色脂肪组织(WAT)中PPARγ及其靶成脂基因的上调也被减弱。功能丧失和功能增强研究表明,HSPA12A缺乏抑制了原代脂肪细胞前体的分化以及分化过程中PPARγ和目标脂肪形成基因的表达,而HSPA12A的过表达促进了这种作用。重要的是,GW9662对PPARγ的抑制作用逆转了HSPA12A介导的脂肪细胞分化。另一方面,在原代脂肪细胞中,HSPA12A表达受PPARγ抑制而下调,但受PPARγ激活而上调。通过染色质免疫沉淀测定法证实了PPARγ与Hspa12a启动子区域中PPAR反应元件的直接结合,并在原代脂肪细胞分化后增加了这种结合。这些发现表明,HSPA12A通过PPARγ的正反馈调节,是脂肪细胞分化和饮食诱导的肥胖的新型调节剂。抑制HSPA12A可能代表了管理肥胖症的可行策略。

"点击查看英文标题和摘要"
更新日期:2019-02-11

"点击查看英文标题和摘要"













































 京公网安备 11010802027423号
京公网安备 11010802027423号