当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
依赖于TonB的转运蛋白FhuA和TonB之间的动态蛋白质-蛋白质偶联。
Biochemistry ( IF 2.9 ) Pub Date : 2018-01-26 00:00:00 , DOI: 10.1021/acs.biochem.7b01223 Jessica L. Sarver 1 , Michael Zhang 1 , Lishan Liu 1 , David Nyenhuis 1 , David S. Cafiso 1
Biochemistry ( IF 2.9 ) Pub Date : 2018-01-26 00:00:00 , DOI: 10.1021/acs.biochem.7b01223 Jessica L. Sarver 1 , Michael Zhang 1 , Lishan Liu 1 , David Nyenhuis 1 , David S. Cafiso 1
Affiliation
|
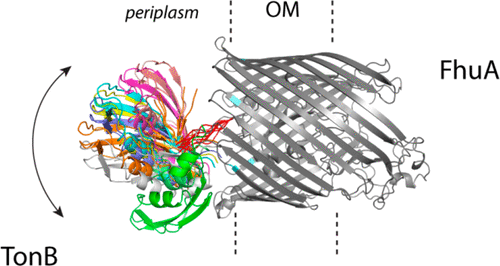
细菌外膜TonB依赖的转运蛋白通过执行与内膜蛋白TonB的结合和解除结合的循环而发挥作用。在维生素B 12转运蛋白BtuB和柠檬酸铁转运蛋白FecA中,底物结合增加了Ton盒(能量耦合部分)的周质暴露。这种增加的暴露似乎增强了转运蛋白对TonB的亲和力。在这里,连续波和脉冲EPR光谱用于检查大肠杆菌中Ton盒的状态铬铁转运蛋白FhuA。在其载脂蛋白状态下,FhuA的Ton框可对范围广泛的位置和多个构象亚状态进行采样。当绑定到铁铬铁时,尽管FhuA Ton盒采样的结构状态发生了变化,但Ton盒并没有进一步延伸到周质中。当与TonB的可溶性片段结合时,TonB-FhuA复合物保持异质和动态,表明TonB与FhuA桶或转运蛋白的核心区域不形成牢固的特异性接触。该结果不同于在TonB–FhuA络合物的晶体结构中看到的结果。这些数据表明,与BtuB和FecA不同,在存在底物的情况下,FhuA中Ton框的周质暴露不会发生显着变化,并且转运蛋白-TonB相互作用的变构控制是通过与BtuB或FecA不同的机制起作用的。此外,数据表明涉及TonB相对于转运蛋白旋转的模型不太可能成为驱动依赖TonB的转运的机制的基础。

"点击查看英文标题和摘要"
更新日期:2018-01-26

"点击查看英文标题和摘要"






























 京公网安备 11010802027423号
京公网安备 11010802027423号