当前位置:
X-MOL 学术
›
Anal. Chim. Acta
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Supercharging protein ions in native mass spectrometry using theta capillary nanoelectrospray ionization mass spectrometry and cyclic alkylcarbonates
Analytica Chimica Acta ( IF 5.7 ) Pub Date : 2018-03-01 , DOI: 10.1016/j.aca.2017.11.075 Huixin Wang , Grace Yong , Susannah L. Brown , Hyun Eui Lee , Muhammad A. Zenaidee , Claudiu T. Supuran , William A. Donald
Analytica Chimica Acta ( IF 5.7 ) Pub Date : 2018-03-01 , DOI: 10.1016/j.aca.2017.11.075 Huixin Wang , Grace Yong , Susannah L. Brown , Hyun Eui Lee , Muhammad A. Zenaidee , Claudiu T. Supuran , William A. Donald
|
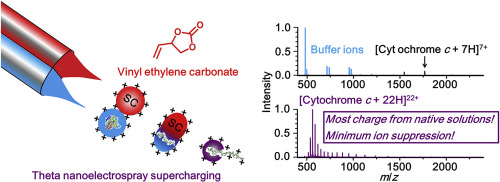
Theta nanoelectrospray ionization of protein ions formed from aqueous buffer solutions that are mixed with denaturing solutions containing cyclic alkylcarbonates (e.g., vinyl ethylene carbonate; VEC) results in a significant increase in the extent of ion charging compared to native mass spectrometry. For six proteins, the extent of ion charging can be significantly higher than that obtained using denaturing solutions and alternative native "supercharging" methods. In theta nanoelectrospray supercharging, the extent of charging scales with protein mass in agreement with an analytical scaling relationship for ions with elongated structures. Theta nanoelectrospray supercharging of non-covalent complexes from native solutions results in essentially the complete loss of protein-ligand and protein-protein interactions. Based on circular dichroism spectroscopy, VEC can effectively denature proteins in buffered solutions. These data provide evidence that enrichment of VEC in theta nanoelectrospray ionization generated droplets can denature proteins on the timescale of droplet desolvation and ion formation. This approach can be used to form highly charged protein ions from native solutions containing biological buffers, including some that are considered incompatible with native MS. Forming some protein ions in the highest reported charge states directly from native solutions is no longer a challenge in obtaining primary structural information using tandem mass spectrometry.
中文翻译:

使用 theta 毛细管纳米电喷雾电离质谱和环状烷基碳酸盐在天然质谱中增压蛋白质离子
与含有环状烷基碳酸酯(例如,乙烯基碳酸亚乙酯;VEC)的变性溶液混合的缓冲水溶液形成的蛋白质离子的 Theta 纳米电喷雾电离导致离子充电程度与原生质谱相比显着增加。对于六种蛋白质,离子充电的程度可以显着高于使用变性溶液和替代的天然“增压”方法获得的程度。在 theta 纳米电喷雾增压中,充电程度与蛋白质质量成比例,与具有细长结构的离子的分析比例关系一致。来自天然溶液的非共价复合物的 Theta 纳米电喷雾增压基本上导致蛋白质-配体和蛋白质-蛋白质相互作用的完全丧失。基于圆二色光谱,VEC 可以有效地使缓冲溶液中的蛋白质变性。这些数据提供了证据,证明在 theta 纳米电喷雾电离产生的液滴中富集 VEC 可以在液滴去溶剂化和离子形成的时间尺度上使蛋白质变性。这种方法可用于从含有生物缓冲液的天然溶液中形成高度带电的蛋白质离子,包括一些被认为与天然 MS 不兼容的溶液。在使用串联质谱法获取主要结构信息时,直接从天然溶液中形成一些处于最高报告电荷状态的蛋白质离子不再是一个挑战。这些数据提供了证据,证明在 theta 纳米电喷雾电离产生的液滴中富集 VEC 可以在液滴去溶剂化和离子形成的时间尺度上使蛋白质变性。这种方法可用于从含有生物缓冲液的天然溶液中形成高度带电的蛋白质离子,包括一些被认为与天然 MS 不兼容的溶液。在使用串联质谱法获取主要结构信息时,直接从天然溶液中形成一些处于最高报告电荷状态的蛋白质离子不再是一个挑战。这些数据提供了证据,证明在 theta 纳米电喷雾电离产生的液滴中富集 VEC 可以在液滴去溶剂化和离子形成的时间尺度上使蛋白质变性。这种方法可用于从含有生物缓冲液的天然溶液中形成高度带电的蛋白质离子,包括一些被认为与天然 MS 不兼容的溶液。在使用串联质谱法获取主要结构信息时,直接从天然溶液中形成一些处于最高报告电荷状态的蛋白质离子不再是一个挑战。
更新日期:2018-03-01
中文翻译:

使用 theta 毛细管纳米电喷雾电离质谱和环状烷基碳酸盐在天然质谱中增压蛋白质离子
与含有环状烷基碳酸酯(例如,乙烯基碳酸亚乙酯;VEC)的变性溶液混合的缓冲水溶液形成的蛋白质离子的 Theta 纳米电喷雾电离导致离子充电程度与原生质谱相比显着增加。对于六种蛋白质,离子充电的程度可以显着高于使用变性溶液和替代的天然“增压”方法获得的程度。在 theta 纳米电喷雾增压中,充电程度与蛋白质质量成比例,与具有细长结构的离子的分析比例关系一致。来自天然溶液的非共价复合物的 Theta 纳米电喷雾增压基本上导致蛋白质-配体和蛋白质-蛋白质相互作用的完全丧失。基于圆二色光谱,VEC 可以有效地使缓冲溶液中的蛋白质变性。这些数据提供了证据,证明在 theta 纳米电喷雾电离产生的液滴中富集 VEC 可以在液滴去溶剂化和离子形成的时间尺度上使蛋白质变性。这种方法可用于从含有生物缓冲液的天然溶液中形成高度带电的蛋白质离子,包括一些被认为与天然 MS 不兼容的溶液。在使用串联质谱法获取主要结构信息时,直接从天然溶液中形成一些处于最高报告电荷状态的蛋白质离子不再是一个挑战。这些数据提供了证据,证明在 theta 纳米电喷雾电离产生的液滴中富集 VEC 可以在液滴去溶剂化和离子形成的时间尺度上使蛋白质变性。这种方法可用于从含有生物缓冲液的天然溶液中形成高度带电的蛋白质离子,包括一些被认为与天然 MS 不兼容的溶液。在使用串联质谱法获取主要结构信息时,直接从天然溶液中形成一些处于最高报告电荷状态的蛋白质离子不再是一个挑战。这些数据提供了证据,证明在 theta 纳米电喷雾电离产生的液滴中富集 VEC 可以在液滴去溶剂化和离子形成的时间尺度上使蛋白质变性。这种方法可用于从含有生物缓冲液的天然溶液中形成高度带电的蛋白质离子,包括一些被认为与天然 MS 不兼容的溶液。在使用串联质谱法获取主要结构信息时,直接从天然溶液中形成一些处于最高报告电荷状态的蛋白质离子不再是一个挑战。




















































 京公网安备 11010802027423号
京公网安备 11010802027423号