当前位置:
X-MOL 学术
›
Bioconjugate Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
CLIP6-PNA-Peptide Conjugates: Non-Endosomal Delivery of Splice Switching Oligonucleotides
Bioconjugate Chemistry ( IF 4.0 ) Pub Date : 2017-12-06 00:00:00 , DOI: 10.1021/acs.bioconjchem.7b00638 Terese Soudah 1 , Maxim Mogilevsky 1 , Rotem Karni 1 , Eylon Yavin 1
Bioconjugate Chemistry ( IF 4.0 ) Pub Date : 2017-12-06 00:00:00 , DOI: 10.1021/acs.bioconjchem.7b00638 Terese Soudah 1 , Maxim Mogilevsky 1 , Rotem Karni 1 , Eylon Yavin 1
Affiliation
|
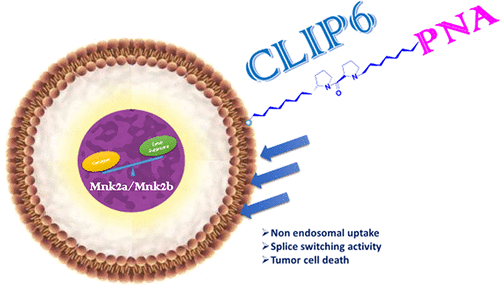
Efficient delivery of oligonucleotides still remains a challenge in the field of oligonucleotide based therapy. Peptide nucleic acid (PNA), a DNA analogue that is typically synthesized by solid phase peptide chemistry, has been conjugated to a variety of cell penetrating peptides (CPP) as a means of improving its cellular uptake. These CPPs typically deliver their cargoes into cells by an endosomal-dependent mechanism resulting in lower bioavailability of the cargo. Herein, we designed and synthesized PNA–peptide conjugates as splice switching oligonucleotides (SSO) targeting the Mnk2 gene, a therapeutic target in cancer. In humans, the MKNK2 gene, is alternatively spliced, generating isoforms with opposite biological activities: Mnk2a and Mnk2b. It was found that the Mnk2a isoform is down-regulated in breast, lung, brain, and colon tumors and is a tumor suppressor, whereas MnK2b is oncogenic. We have designed and synthesized PNAs that were conjugated to either of the following peptides: a nuclear localization sequence (NLS) or a cytosol localizing internalization peptide (CLIP6). CLIP6-PNA demonstrates effective cellular uptake and exclusively employs a nonendosomal mechanism to cross the cellular membranes of glioblastoma cells (U87). Simple incubation of PNA–peptide conjugates in human glioblastoma cells up-regulates the Mnk2a isoform leading to cancer cell death.
中文翻译:

CLIP6-PNA肽缀合物:剪接开关寡核苷酸的非内体传递。
在基于寡核苷酸的治疗领域中,有效递送寡核苷酸仍然是一个挑战。肽核酸(PNA)是一种通常通过固相肽化学合成的DNA类似物,已与多种细胞穿透肽(CPP)偶联,以改善其细胞吸收能力。这些CPP通常通过内体依赖性机制将其货物递送到细胞中,从而导致货物的生物利用度降低。在本文中,我们设计并合成了PNA-肽共轭物,将其作为靶向Mnk2基因(癌症的治疗靶标)的剪接转换寡核苷酸(SSO)。在人类中,MKNK2基因被选择性剪接,产生具有相反生物学活性的同工型:Mnk2a和Mnk2b。发现Mnk2a亚型在乳腺,肺,脑,和结肠肿瘤,并且是肿瘤抑制因子,而MnK2b具有致癌性。我们设计并合成了与以下任何一种肽缀合的PNA:核定位序列(NLS)或胞浆定位内化肽(CLIP6)。CLIP6-PNA证明有效的细胞摄取,并专门采用非内体机制穿越胶质母细胞瘤细胞(U87)的细胞膜。在人胶质母细胞瘤细胞中简单孵育PNA-肽结合物会上调Mnk2a亚型,导致癌细胞死亡。CLIP6-PNA证明有效的细胞摄取,并专门采用非内体机制穿越胶质母细胞瘤细胞(U87)的细胞膜。在人胶质母细胞瘤细胞中简单孵育PNA-肽结合物会上调Mnk2a亚型,导致癌细胞死亡。CLIP6-PNA证明有效的细胞摄取,并专门采用非内体机制穿越胶质母细胞瘤细胞(U87)的细胞膜。在人胶质母细胞瘤细胞中简单孵育PNA-肽结合物会上调Mnk2a亚型,导致癌细胞死亡。
更新日期:2017-12-06
中文翻译:

CLIP6-PNA肽缀合物:剪接开关寡核苷酸的非内体传递。
在基于寡核苷酸的治疗领域中,有效递送寡核苷酸仍然是一个挑战。肽核酸(PNA)是一种通常通过固相肽化学合成的DNA类似物,已与多种细胞穿透肽(CPP)偶联,以改善其细胞吸收能力。这些CPP通常通过内体依赖性机制将其货物递送到细胞中,从而导致货物的生物利用度降低。在本文中,我们设计并合成了PNA-肽共轭物,将其作为靶向Mnk2基因(癌症的治疗靶标)的剪接转换寡核苷酸(SSO)。在人类中,MKNK2基因被选择性剪接,产生具有相反生物学活性的同工型:Mnk2a和Mnk2b。发现Mnk2a亚型在乳腺,肺,脑,和结肠肿瘤,并且是肿瘤抑制因子,而MnK2b具有致癌性。我们设计并合成了与以下任何一种肽缀合的PNA:核定位序列(NLS)或胞浆定位内化肽(CLIP6)。CLIP6-PNA证明有效的细胞摄取,并专门采用非内体机制穿越胶质母细胞瘤细胞(U87)的细胞膜。在人胶质母细胞瘤细胞中简单孵育PNA-肽结合物会上调Mnk2a亚型,导致癌细胞死亡。CLIP6-PNA证明有效的细胞摄取,并专门采用非内体机制穿越胶质母细胞瘤细胞(U87)的细胞膜。在人胶质母细胞瘤细胞中简单孵育PNA-肽结合物会上调Mnk2a亚型,导致癌细胞死亡。CLIP6-PNA证明有效的细胞摄取,并专门采用非内体机制穿越胶质母细胞瘤细胞(U87)的细胞膜。在人胶质母细胞瘤细胞中简单孵育PNA-肽结合物会上调Mnk2a亚型,导致癌细胞死亡。




















































 京公网安备 11010802027423号
京公网安备 11010802027423号