当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
单域金属硫蛋白:人类 MT 1a 的超金属化
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2012-02-06 , DOI: 10.1021/ja211767m
Duncan E. K. Sutherland 1 , Mathew J. Willans 1 , Martin J. Stillman 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2012-02-06 , DOI: 10.1021/ja211767m
Duncan E. K. Sutherland 1 , Mathew J. Willans 1 , Martin J. Stillman 1
Affiliation
|
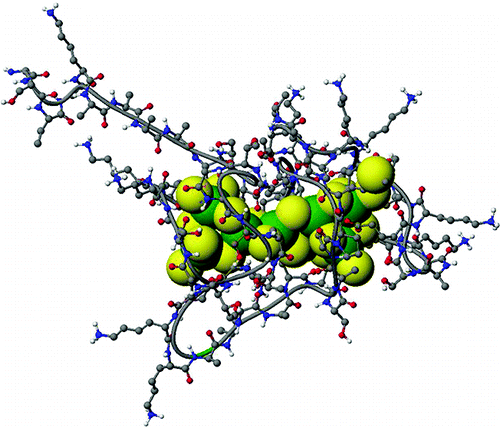
金属硫蛋白是一个小的、富含半胱氨酸的蛋白质家族,其具有一系列作用,包括有毒金属解毒、防止氧化应激,以及作为参与必需锌和铜稳态的金属伴侣。我们报告说,众所周知,人类金属硫蛋白 1a 可以将 7 个 Zn(2+) 或 Cd(2+) 离子与 20 个半胱氨酰硫醇结合,将结合 8 个结构上重要的 Cd(2+) 离子,从而导致超金属化 Cd 的形成(8)-βα-rhMT 1a 物种,其结构是一个新的单域。使用 ESI 质谱法来确定 βα-rhMT 的确切金属化状态。Cd(7)-βα-rhMT [峰值极值 (+) 260 和 (-) 239 nm] 的衍生形 CD 包膜在 Cd(8)-βα-rhMT 形成后发生剧烈变化,并出现尖锐的单相CD 波段以 252 nm 为中心,这一特征表明簇对称性丧失。从直接和间接 (113) Cd 核磁共振 (NMR) 光谱的组合确定第八个 Cd(2+) 离子的结构意义。在 Cd(8)-βα-rhMT 的情况下,在直接 (113)Cd NMR 光谱中仅观察到四个峰。值得注意的是,虽然两个孤立的域都可以被超金属化形成 Cd(4)-β-rhMT 和 Cd(5)-α-rhMT,但观察到 Cd(8)-βα-rhMT 而不是 Cd(9)-βα-rhMT加入过量的 Cd(2+) 后。我们建议两个域协同作用以协调第八个 Cd(2+) 原子,此外,这种相互作用导致两个域的合并,导致双域结构的崩溃。这是可能的单"超域"金属硫蛋白结构的 Zn(2+) 和 Cd(2+) 绑定哺乳动物蛋白的第一份报告。描述了 Cd(8)-βα-rhMT 可能的单域结构的计算模型。

"点击查看英文标题和摘要"
更新日期:2012-02-06

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号