当前位置:
X-MOL 学术
›
ACS Chem. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
酪氨酸特异的化学修饰与原位血红素活化的鲁米诺衍生物
ACS Chemical Biology ( IF 3.5 ) Pub Date : 2015-09-18 00:00:00 , DOI: 10.1021/acschembio.5b00440 Shinichi Sato 1 , Kosuke Nakamura 1 , Hiroyuki Nakamura 1
ACS Chemical Biology ( IF 3.5 ) Pub Date : 2015-09-18 00:00:00 , DOI: 10.1021/acschembio.5b00440 Shinichi Sato 1 , Kosuke Nakamura 1 , Hiroyuki Nakamura 1
Affiliation
|
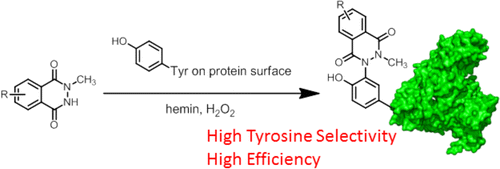
酪氨酸特异性的化学修饰是利用原位的血红素活化的鲁米诺衍生物实现的。N-甲基化鲁米诺衍生物在氧化条件下,在血红素和H 2 O 2存在下,可以有效地修饰肽和蛋白质中的酪氨酸残基。酪氨酸残基的单修饰和双修饰都发生在血管紧张素II与N-甲基化鲁米诺衍生物9的反应中。模型蛋白牛血清白蛋白(BSA)的酪氨酸特异性化学修饰显示9选择性修饰了表面暴露的酪氨酸残基。我们使用叠氮化物共轭化合物18成功实现了几种蛋白质的功能化通过铜(I)催化的叠氮化物-炔烃环加成(CuAAC)或二苯并环辛炔(DBCO)介导的无铜点击化学,使用炔共轭探针。该酪氨酸特异性修饰与通过N-羟基琥珀酰亚胺(NHS)酯进行的常规赖氨酸修饰正交,并且在不影响修饰效率的情况下,通过酪氨酸残基的荧光修饰和赖氨酸残基的PEG修饰实现了双重功能化。

"点击查看英文标题和摘要"
更新日期:2015-09-18

"点击查看英文标题和摘要"






























 京公网安备 11010802027423号
京公网安备 11010802027423号