当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
相似的活性位点和机制不会导致有机磷酸酯水解中的交叉混乱:对生物治疗工程的影响
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2017-11-21 , DOI: 10.1021/jacs.7b09384 Miha Purg 1 , Mikael Elias 2 , Shina Caroline Lynn Kamerlin 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2017-11-21 , DOI: 10.1021/jacs.7b09384 Miha Purg 1 , Mikael Elias 2 , Shina Caroline Lynn Kamerlin 1
Affiliation
|
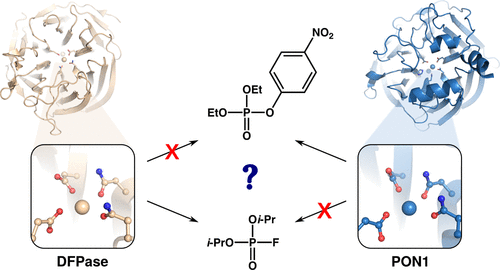
有机磷酸酯水解酶是分解神经毒性有机磷酸酯的有效催化剂,并且作为治疗急性有机磷酸酯毒性的生物治疗剂和生物修复剂具有巨大的潜力。然而,血清对氧磷酶 1 (PON1) 等高效有机磷酸酶和有机磷酸酯水解内酯酶 SsoPox 无法水解具有挑战性离去基团的大有机磷酸酯,如氟磷酸二异丙酯 (DFP) 或毒剂 X,这给酶设计带来了重大挑战。奇怪的是,尽管 PON1 和二异丙基氟磷酸酶 (DFPase) 具有相互排斥的底物特异性,但它们具有基本相同的活性位点和三级结构。在目前的工作中,我们使用经验价键模拟来探讨 DFPase 的催化机制以及温度、pH 和突变效应,证明 DFPase 和 PON1 也可能利用相同的催化机制来水解各自的底物。然而,对静态结构和动态模拟的详细检查表明,两个活性位点的静电特性和溶剂渗透性存在细微但显着的差异,最关键的是,不与任一基材直接接触的残留物在充当“特异性”方面的作用。在两种酶之间进行“切换”。具体来说,我们证明了对 PON1 的对氧磷酶活性在结构和功能上至关重要的关键残基,阻止其利用其氟离去基团水解 DFP。这些见解扩展了我们对具有相同活性位点的酶中不同底物特异性进化驱动因素的理解,并指导了有机磷酸酯水解酶的未来设计,该酶可水解具有挑战性离去基团的化合物。

"点击查看英文标题和摘要"
更新日期:2017-11-21

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号