Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Arrhythmogenic cardiomyopathy related DSG2 mutations affect desmosomal cadherin binding kinetics.
Scientific Reports ( IF 3.8 ) Pub Date : 2017-Oct-23 , DOI: 10.1038/s41598-017-13737-x
Mareike Dieding , Jana Davina Debus , Raimund Kerkhoff , Anna Gaertner-Rommel , Volker Walhorn , Hendrik Milting , Dario Anselmetti
Scientific Reports ( IF 3.8 ) Pub Date : 2017-Oct-23 , DOI: 10.1038/s41598-017-13737-x
Mareike Dieding , Jana Davina Debus , Raimund Kerkhoff , Anna Gaertner-Rommel , Volker Walhorn , Hendrik Milting , Dario Anselmetti
|
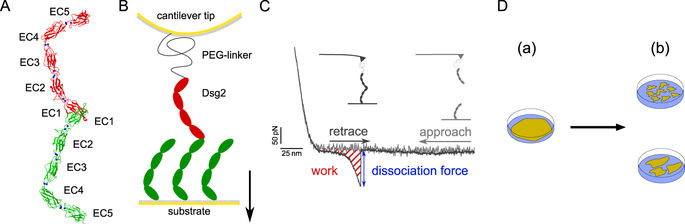
Cadherins are calcium dependent adhesion proteins that establish the intercellular mechanical contact by bridging the gap to adjacent cells. Desmoglein-2 (Dsg2) is a specific cadherin of the cell-cell contact in cardiac desmosomes. Mutations in the DSG2-gene are regarded to cause arrhythmogenic (right ventricular) cardiomyopathy (ARVC) which is a rare but severe heart muscle disease. The molecular pathomechanisms of the vast majority of DSG2 mutations, however, are unknown. Here, we investigated the homophilic binding of wildtype Dsg2 and two mutations which are associated with ARVC. Using single molecule force spectroscopy and applying Jarzynski's equality we determined the kinetics and thermodynamics of Dsg2 homophilic binding. Notably, the free energy landscape of Dsg2 dimerization exposes a high activation barrier which is in line with the proposed strand-swapping binding motif. Although the binding motif is not directly affected by the mutations the binding kinetics differ significantly from the wildtype. Furthermore, we applied a dispase based cell dissociation assay using HT1080 cell lines over expressing Dsg2 wildtype and mutants, respectively. Our molecular and cellular results consistently demonstrate that Dsg2 mutations can heavily affect homophilic Dsg2 interactions. Furthermore, the full thermodynamic and kinetic description of Dsg2 dimerization provides a consistent model of the so far discussed homophilic cadherin binding.
中文翻译:

与心律失常性心肌病相关的DSG2突变影响桥粒钙粘蛋白的结合动力学。
钙黏着蛋白是钙依赖性粘附蛋白,其通过将缺口桥接到相邻细胞来建立细胞间机械接触。桥粒芯蛋白2(Dsg2)是心脏桥粒中细胞间接触的特定钙黏着蛋白。DSG2基因的突变被认为会引起心律失常(右心室)心肌病(ARVC),这是一种罕见但严重的心肌病。然而,绝大多数DSG2突变的分子病理机制尚不清楚。在这里,我们调查了野生型Dsg2和与ARVC相关的两个突变的同源结合。使用单分子力谱并应用Jarzynski的等式,我们确定了Dsg2同源结合的动力学和热力学。尤其,Dsg2二聚化的自由能格局暴露了一个高活化壁垒,这与拟议的链交换结合基序是一致的。尽管结合基序不受突变直接影响,但结合动力学与野生型显着不同。此外,我们应用了基于Dispase的细胞解离分析,分别使用了分别表达Dsg2野生型和突变体的HT1080细胞系。我们的分子和细胞结果一致表明Dsg2突变会严重影响同型Dsg2的相互作用。此外,Dsg2二聚化的完整热力学和动力学描述为迄今为止讨论的同型钙粘蛋白结合提供了一个一致的模型。尽管结合基序不受突变直接影响,但结合动力学与野生型显着不同。此外,我们应用了基于Dispase的细胞解离分析,分别使用了分别表达Dsg2野生型和突变体的HT1080细胞系。我们的分子和细胞结果一致表明Dsg2突变会严重影响同型Dsg2的相互作用。此外,Dsg2二聚化的完整热力学和动力学描述为迄今为止讨论的同型钙粘蛋白结合提供了一个一致的模型。尽管结合基序不受突变直接影响,但结合动力学与野生型显着不同。此外,我们应用了基于Dispase的细胞解离分析,分别使用了分别表达Dsg2野生型和突变体的HT1080细胞系。我们的分子和细胞结果一致表明Dsg2突变会严重影响同型Dsg2的相互作用。此外,Dsg2二聚化的完整热力学和动力学描述为迄今为止讨论的同型钙粘蛋白结合提供了一个一致的模型。我们的分子和细胞结果一致表明Dsg2突变会严重影响同型Dsg2的相互作用。此外,Dsg2二聚化的完整热力学和动力学描述为迄今为止讨论的同型钙粘蛋白结合提供了一个一致的模型。我们的分子和细胞结果一致表明Dsg2突变会严重影响同型Dsg2的相互作用。此外,Dsg2二聚化的完整热力学和动力学描述为迄今为止讨论的同型钙粘蛋白结合提供了一个一致的模型。
更新日期:2017-10-23
中文翻译:

与心律失常性心肌病相关的DSG2突变影响桥粒钙粘蛋白的结合动力学。
钙黏着蛋白是钙依赖性粘附蛋白,其通过将缺口桥接到相邻细胞来建立细胞间机械接触。桥粒芯蛋白2(Dsg2)是心脏桥粒中细胞间接触的特定钙黏着蛋白。DSG2基因的突变被认为会引起心律失常(右心室)心肌病(ARVC),这是一种罕见但严重的心肌病。然而,绝大多数DSG2突变的分子病理机制尚不清楚。在这里,我们调查了野生型Dsg2和与ARVC相关的两个突变的同源结合。使用单分子力谱并应用Jarzynski的等式,我们确定了Dsg2同源结合的动力学和热力学。尤其,Dsg2二聚化的自由能格局暴露了一个高活化壁垒,这与拟议的链交换结合基序是一致的。尽管结合基序不受突变直接影响,但结合动力学与野生型显着不同。此外,我们应用了基于Dispase的细胞解离分析,分别使用了分别表达Dsg2野生型和突变体的HT1080细胞系。我们的分子和细胞结果一致表明Dsg2突变会严重影响同型Dsg2的相互作用。此外,Dsg2二聚化的完整热力学和动力学描述为迄今为止讨论的同型钙粘蛋白结合提供了一个一致的模型。尽管结合基序不受突变直接影响,但结合动力学与野生型显着不同。此外,我们应用了基于Dispase的细胞解离分析,分别使用了分别表达Dsg2野生型和突变体的HT1080细胞系。我们的分子和细胞结果一致表明Dsg2突变会严重影响同型Dsg2的相互作用。此外,Dsg2二聚化的完整热力学和动力学描述为迄今为止讨论的同型钙粘蛋白结合提供了一个一致的模型。尽管结合基序不受突变直接影响,但结合动力学与野生型显着不同。此外,我们应用了基于Dispase的细胞解离分析,分别使用了分别表达Dsg2野生型和突变体的HT1080细胞系。我们的分子和细胞结果一致表明Dsg2突变会严重影响同型Dsg2的相互作用。此外,Dsg2二聚化的完整热力学和动力学描述为迄今为止讨论的同型钙粘蛋白结合提供了一个一致的模型。我们的分子和细胞结果一致表明Dsg2突变会严重影响同型Dsg2的相互作用。此外,Dsg2二聚化的完整热力学和动力学描述为迄今为止讨论的同型钙粘蛋白结合提供了一个一致的模型。我们的分子和细胞结果一致表明Dsg2突变会严重影响同型Dsg2的相互作用。此外,Dsg2二聚化的完整热力学和动力学描述为迄今为止讨论的同型钙粘蛋白结合提供了一个一致的模型。

































 京公网安备 11010802027423号
京公网安备 11010802027423号